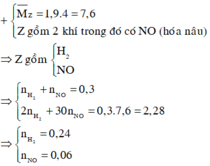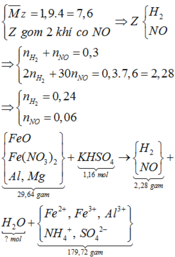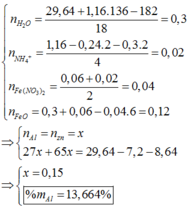Tính khối lượng mỗi chất có trong 11g hỗn hợp Al, Fe trong đó số mol Al bằng 2 lần số mol Fe.
Mong các bạn giúp mình nhanh nhá, mình đang cần lắm ạ, thank you !
Những câu hỏi liên quan
hòa tan hết hỗn hợp kim loại gồm : Al , Mg , Fe trong dung dịch HCl thaayssinh ra 49,28 lí khí H2 (đktc) . cho biết trong hỗn hợp số mol Fe chỉ bằng 2/3 số mol Mg và bằng một nửa số mol Al . hãy xác định khối lượng của mỗi kim loại có trong hỗn hợp và thành phần phần trăm về khối lương của mỗi kim loại
các anh , chi giỏi hóa giúp e với
Mg ko pư vs HCl
Gọi số mol của Fe là a(a>0)
=> nAl= 2a(mol)
nMg = 3/2 a (mol)
nH2=49,28/22,4=2,2(mol)
PTHH
Fe + 2HCl ------> FeCl2 + H2
a a (mol)
2Al + 6HCl ------> 2AlCl3 + 3H2
2a 3a (mol)
=> nH2 = a+3a=4a=2,2(mol)
=> a=0,55 = nFe
=> nAl = 2a = 1,1 ( mol)
nMg = 0,825 ( mol)
%mFe = ( 0,55.56)/(0,55.56 + 1,1.27 + 0,825.24) . 100% = 38,35 %
%mAl =(1,1.27)/(0,55.56 + 1,1.27 + 0,825.24) . 100% = 37%
%mMg = 100% - %mFe - %mAl = 100% -38,36%-37% = 24,65%
( kết quả có thể khác , bn tự lm lại theo hướng này )
#Học-tốt
1. Cần lấy bao nhiêu gam Zn để có số nguyên tử gấp 3 lần số nguyên tử có trong 5,6 g Fe
2. Tính số mol, khối lượng, số phân tử của 4,48 lít khí cacbondioxit ( đktc )
3. tính khối lượng mỗi nguyên tố có trong 100g muối Fe2( SO4)3
CÁC BẠN GIÚP MÌNH NHA, MÌNH ĐANG GẤP LẮM. CẢM ƠN CÁC BẠN!!!
\(1,+n_{fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
số nguyên tử của Fe là 0,1.6.10\(^{23}\)=0,6.10\(^{23}\)
=> số nguyên tử của Zn là 3.0,6.10\(^{23}\)=1,8.10\(^{23}\)
+ n\(_{zn}\)= \(\dfrac{1,8.10^{23}}{6.10^{23}}\)=0,3 mol
=> m \(_{Zn}\)=0,3.65=19,5g ( đpcm)
Đúng 0
Bình luận (0)
em cần gấp nhờ giúp cái ạ F22: Tính số mol mỗi kim loại ? Biết :a. 9,96 gam hỗn hợp X ( Fe , Al có tỷ lệ mol 1 : 1) .b. 27,6 gam hỗn hợp Y ( Fe , Cu có tỷ lệ mol 1 : 2) .c. 29,52 gam hỗn hợp Z ( Cu, Al có tỷ lệ mol 3 : 2 ) . F23: 11 gam hỗn hợp X (Al, Fe) có tổng số mol là 0,3. Tính khối lượng mỗi kim loại ?
Đọc tiếp
em cần gấp nhờ giúp cái ạ ![]()
F22: Tính số mol mỗi kim loại ? Biết :
a. 9,96 gam hỗn hợp X ( Fe , Al có tỷ lệ mol 1 : 1) .
b. 27,6 gam hỗn hợp Y ( Fe , Cu có tỷ lệ mol 1 : 2) .
c. 29,52 gam hỗn hợp Z ( Cu, Al có tỷ lệ mol 3 : 2 ) .
F23: 11 gam hỗn hợp X (Al, Fe) có tổng số mol là 0,3. Tính khối lượng mỗi kim loại ?
F22: Tính số mol mỗi kim loại ? Biết :
a. 9,96 gam hỗn hợp X ( Fe , Al có tỷ lệ mol 1 : 1) .
Gọi x, y lần lượt là số mol Fe, Al
\(\left\{{}\begin{matrix}56x+27y=9,96\\x=y\end{matrix}\right.\)
=> x=y= 0,12(mol)
b. 27,6 gam hỗn hợp Y ( Fe , Cu có tỷ lệ mol 1 : 2) .
Gọi x, y lần lượt là số mol Fe, Cu
\(\left\{{}\begin{matrix}56x+64y=27,6\\\dfrac{x}{y}=\dfrac{1}{2}\end{matrix}\right.\)
=> x= 0,15; y=0,3
c. 29,52 gam hỗn hợp Z ( Cu, Al có tỷ lệ mol 3 : 2 ) .
Gọi x, y lần lượt là số mol Cu, Al
\(\left\{{}\begin{matrix}64x+27y=29,52\\\dfrac{x}{y}=\dfrac{3}{2}\end{matrix}\right.\)
=> x= 0,36 ; y=0,24
F23: 11 gam hỗn hợp X (Al, Fe) có tổng số mol là 0,3. Tính khối lượng mỗi kim loại ?
Gọi x, y lần lượt là số mol Al, Fe
\(\left\{{}\begin{matrix}27x+56y=11\\x+y=0,3\end{matrix}\right.\)
=> x=0,2 , y =0,1
=> \(\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
cho 1,41g hỗn hợp 2 kim loại Al và Mg tác dụng với dung dịch H2SO4 dư phản ứng xong thu được 1568ml khí đktc .Tính thành phần phần trăm theo khối lượng và theo số mol của mỗi kim loại trong hỗn hợp đầu
các bạn giúp mình vs ak mình cần gấp lắm . mình cảm ơn
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 (1)
2 3 1 3 ( mol)
2x 3x x 3x
Mg + H2SO4 -> MgSO4 +H2 (2)
1 1 1 1
y y y y
Gọi số mol của Al là x
=> nAl = 2x, nH2SO4 = 3x, nAl2(SO4)3= x , nH2= 3x
Gọi số mol của Mg là y
=> nMg = y, nH2SO4 = y, nMgSO4 = y, nH2= y
Ta có:
mhh = mAl + mMg
1,41= 27.2x + 24y
1,41= 54x + 24y
V H2 (1) + V H2 (2) = 1,568 (1568ml = 1,568 l)
22,4 . 3x + 22,4y = 1,568
67,2x + 22.4y = 1,568
Có : - 54x + 24y=1,41
- 67,2x + 22.4y = 1,568
Bấm máy tính => x = 0,015
y = 0,025
mAl = 54x = 54 . 0,015 = 0,81 9(g)
mMg = 1,41 - 0,81 = 0,6 (g)
%mAl = 0,81 . 100 / 1,41 = 57,45%
%mMg = 100% - 57,45% = 42,55%
Đúng 1
Bình luận (0)
Tính khối lượng của Al và Fe có trong 11 gam hỗn hợp Al và Fe. Biết trong hỗn hợp đó, số mol của Al gấp 2lần số mol của Fe
Gọi số mol của Al và Fe lần lượt là x và y
Vì số mol của Al gấp 2 lần Fe nên x=2y (1)
Và khối lượng của Fe và Al là 11g nên
27x+56y=12 (2)
Giải HPT: \(\left\{{}\begin{matrix}\text{27x+56y=12 }\\\text{x=2y }\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}\text{x=0,2 mol}\\\text{y=0,1 mol}\end{matrix}\right.\)
\(\rightarrow\)mAl=27.0,2=5,4
mAl=56.0,1=5,6
Giúp em với ạ!!! Em đang cần gấp
Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl dư thu được 5,6 lít khí và 2 gam chất không tan. Tính % khối lượng mỗi kim loại trong hỗn hợp đầu.
\(m_{không.tan}=m_{Cu}=2\left(g\right)\\ \Rightarrow m_{Al,Fe}=10,3-2=8,3\left(g\right)\\ Đặt:a=n_{Al}\left(mol\right);b=n_{Fe}\left(mol\right)\left(a,b>0\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=8,3\\1,5.22,4a+22,4b=5,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \Rightarrow\%m_{Cu}=\dfrac{2}{10,3}.100\approx19,417\%\\ \%m_{Fe}=\dfrac{56.0,1}{10,3}.100\approx54,369\%\\ \Rightarrow\%m_{Al}\approx26,214\%\)
Đúng 1
Bình luận (0)
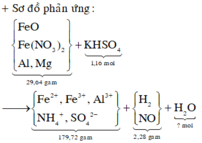
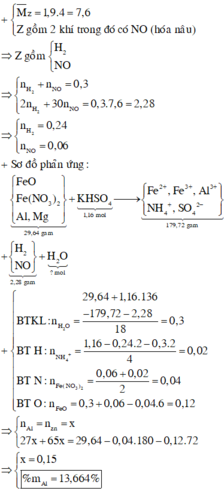
Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là A. 13,664%. B. 14,228%. C. 15,112%. D. 16,334%.
Đọc tiếp
Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là
A. 13,664%.
B. 14,228%.
C. 15,112%.
D. 16,334%.
Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là A. 13,664%. B. 14,228%. C. 15,112%. D. 16,334%.
Đọc tiếp
Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là
A. 13,664%.
B. 14,228%.
C. 15,112%.
D. 16,334%.
Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là A. 13,664%. B. 14,228%. C. 15,112%. D. 16,334%.
Đọc tiếp
Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là
A. 13,664%.
B. 14,228%.
C. 15,112%.
D. 16,334%.