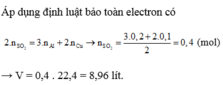Cho 11,2 gam FexOy tác dụng H2SO 4 đặc nóng được V lít SO2(đktc). Tính V

Những câu hỏi liên quan
cho 16,8 gam Fe tác dụng vừa đủ với dung dịch H2SO4 đặc nóng, thu được dung dịch A và V lít khí SO2(đktc) A) Tính V B) Cho dung dịch A tác dụng hoàn toàn với dung dịch NaOH thu được m gam kết tủa. Tính m
a, \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
BT e, có: 3nFe = 2nSO2 ⇒ nSO2 = 0,45 (mol)
⇒ VSO2 = 0,45.22,4 = 10,08 (l)
b, BTNT Fe, có: nFe(OH)3 = nFe = 0,3 (mol)
⇒ mFe(OH)3 = 0,3.107 = 32,1 (g)
Đúng 1
Bình luận (0)
Đốt cháy 11,2 gam Fe ngoài không khí một thời gian thu được 15,04 gam hỗn hợp X gồm Fe FeO Fe304 Fe2O3 cho toàn bộ X tác dụng với H2SO4 đặc nóng thu được V lít (điều kiện tiêu chuẩn )khí SO2 (sản phẩm khử duy nhất) .Tính V
\(m_{O_2}=15.04-11.2=3.85\left(g\right)\)
\(n_{O_2}=\dfrac{3.85}{32}=0.1203125\left(mol\right)\)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
Bảo toàn e :
\(n_{SO_2}=\dfrac{3\cdot0.2-0.1203125\cdot4}{2}=0.059375\left(mol\right)\)
\(V_{SO_2}=1.33\left(l\right)\)
Đúng 1
Bình luận (2)
6. Cho 11,2 gam kim loại sắt tác dụng với axit H2SO4 đặc nóng, thu được bao nhiêu lít khí SO2 (đktc). Biết trong quá trình thu khí hao hụt mất 3%.
$n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$2Fe +6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
$n_{SO_2} = \dfrac{3}{2}n_{Fe} = 0,3(mol)$
$n_{SO_2\ hao\ hụt} = 0,3.3\% = 0,009(mol)$
$V_{SO_2} = (0,3 - 0,009).22,4 = 6,5184(lít)$
Đúng 0
Bình luận (0)
Hòa tan m gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam Fe tác dụng với H2SO4 đặc, nóng, dư thì thu được V lít khí SO2 (đktc). Giá trị của V là A. 10,08. B. 5,04. C. 3,36. C. 3,36.
Đọc tiếp
Hòa tan m gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam Fe tác dụng với H2SO4 đặc, nóng, dư thì thu được V lít khí SO2 (đktc). Giá trị của V là
A. 10,08.
B. 5,04.
C. 3,36.
C. 3,36.
Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
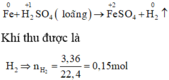
Các quá trình nhường, nhận electron :
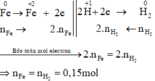
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
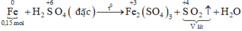
Các quá trình nhường, nhận electron:
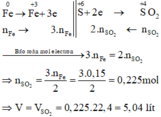
Đúng 0
Bình luận (0)
Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc, nóng, dư. Sau phản ứng thu được V lít SO2 duy nhất (đktc). Giá trị của V là:
A. 6,72 lít.
B. 3,36 lít.
C. 11,2 lít.
D. 8,96 lít.
Đáp án D.
nAl = 0,2 (mol), nCu = 0,1 (mol)
Áp dụng định luật bảo toàn electron có
![]()
→ V = 0,4 . 22,4 = 8,96 lít.
Đúng 0
Bình luận (0)
Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch
H
2
S
O
4
đặc, nóng, dư. Sau phản ứng thu được V lít
S
O
2
duy nhất (đktc). Giá trị của V là A. 6,72 lít. B. 3,36 lít. C. 11,2 lít. D. 8,96 lít.
Đọc tiếp
Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H 2 S O 4 đặc, nóng, dư. Sau phản ứng thu được V lít S O 2 duy nhất (đktc). Giá trị của V là
A. 6,72 lít.
B. 3,36 lít.
C. 11,2 lít.
D. 8,96 lít.
Cho 11,2 gam hỗn hợp gồm Cu và kim loại M tác dụng hết với HCl dư thu được 3,136 lít khí (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít khí SO2 (đktc sản phẩm khử duy nhất). Xác định kim loại M và tính % khối lượng Cu trong hỗn hợp
Cho 11,2 gam hỗn hợp gồm Cu và kim loại M tác dụng hết với HCl dư thu được 3,136 lít khí (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít khí SO2 (đktc sản phẩm khử duy nhất). Xác định kim loại M và tính % khối lượng Cu trong hỗn hợp
Cho 11,2 gam hỗn hợp gồm Cu và kim loại M tác dụng hết với HCl dư thu được 3,136 lít khí (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít khí SO2 (đktc sản phẩm khử duy nhất). Xác định kim loại M và tính % khối lượng Cu trong hỗn hợp