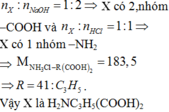Cho 200ml H2O tác dụng với 4,6g Na. Tính C% của dung dịch thu được. Biết rằng DH2O=1g/ml.
́Mong mng giúp ạ :<

Những câu hỏi liên quan
Cho 5,6 gam canxi tác dụng với nước thu được 200ml dung dịch Canxi hiđroxit.
a, Viết phương trình hóa học cho phản ứng xảy ra
b, Tính nồng độ mol của dung dịch thu được
c, Tính thể tích CO2(đktc) vừa đủ tác dụng với dung dịch canxi hiđroxit trên để tạo thành muối trung hòa
a) \(Ca+2H_2O-->Ca\left(OH\right)_2+H_2\)
\(n_{Ca}=\dfrac{5,6}{40}=0,14\left(mol\right)\)
b)Theo PT:
\(n_{Ca\left(OH\right)_2}=n_{Ca}=0,14\left(mol\right)\)
=> \(C_M=0,14.0,2=0,028\left(M\right)\)
PTHH: \(Ca\left(OH\right)_2+CO_2-->CaCO_3+H_2O\)
Theo PT:
\(n_{CO_2}=n_{Ca\left(OH\right)_2}=0,14\left(mol\right)\)
=> \(V_{CO_2}=0,14.22,4=3,136\left(lit\right)\)
Đúng 0
Bình luận (0)
Cho m gam bột sắt tác dụng hoàn toàn với dung dịch HCl 10% thu được 1,12lit khí hidro ( ở đktc )
a , Viết PTHH của phản ứng trên
b , Tính khối lượng bột sắt ( m )
c , Tính khối lượng dung dịch HCl cần dùng ( Biết : Fe = 56 ; H=1 )
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,05__0,1____________0,05 (mol)
b, mFe = 0,05.56 = 2,8 (g)
c, mHCl = 0,1.36,5 = 3,65 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{3,65}{10\%}=36,5\left(g\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.05......0.1...................0.05\)
\(m_{Fe}=0.05\cdot56=2.8\left(g\right)\)
\(m_{dd_{HCl}}=\dfrac{0.1\cdot36.5\cdot100}{10}=36.5\left(g\right)\)
Đúng 0
Bình luận (0)
Biết 2,24 lít khí Cacbonic (đktc) tác dụng hết với 200 ml dung dịch
B
a
(
O
H
)
2
, sản phẩm thu được là muối trung hòa và nước.a. Viết phương trình xảy ra.b. Tính nồng độ mol của dung dịch
B
a
(
O
H
)
2
cần dùng.c. Tính khối lượng kết tủa...
Đọc tiếp
Biết 2,24 lít khí Cacbonic (đktc) tác dụng hết với 200 ml dung dịch B a ( O H ) 2 , sản phẩm thu được là muối trung hòa và nước.
a. Viết phương trình xảy ra.
b. Tính nồng độ mol của dung dịch B a ( O H ) 2 cần dùng.
c. Tính khối lượng kết tủa thu được
Cho Al tác dụng với 200ml dung dịch axit clohiddric 1M (Ddung dịch HCL= 1,8g/ml)
A) tính thể tích khí thoát ra ở ĐKTC
B) tính Khối lượng nhôm tham gia phản ứng
C) tính nồng độ% của dung dịch muối thu được( thể tích dung dịch không thay đổi)
a.Ta có: nHCl=1.\(\frac{200}{1000}\)=0,2(mol)
Ta có phương trình 2Al + 6HCl -----> 2AlCl3 + 3H2 (1)
Theo phương trình: 2 mol 6 mol 3 mol
Theo đề: x mol 0,2 mol 0,1 mol
=> V\(H_2\)=0,1.22,4=2,24(l)
b. Từ pt (1), ta có:
mAl=x.27=\(\frac{0,2.2}{6}\).27=1,8(g)
c.Từ pt (1), ta có: mHCl=0,2. (1+35,5)=7,3(g)
mdd=\(\frac{200}{1000}.22,4.18=80,64\left(g\right)\)
=>C%=\(\frac{7,3}{80,64}.100\%=9,1\%\)
Ungr hộ nha!
Đúng 0
Bình luận (0)
Cho 0,02 mol amino axit X tác dụng vừa đủ với 200ml dung dịch HCl 0,1 M thu được 3,67 gam muối khan. Mặt khác 0,02 mol X tác dụng vừa đủ với 40 gam dung dịch NaOH 4%. Công thức của X là A. (H2N)2C3H5COOH B. H2NC2C2H3(COOH)2 C. H2NC3H6COOH D. H2NC3H5(COOH)2
Đọc tiếp
Cho 0,02 mol amino axit X tác dụng vừa đủ với 200ml dung dịch HCl 0,1 M thu được 3,67 gam muối khan. Mặt khác 0,02 mol X tác dụng vừa đủ với 40 gam dung dịch NaOH 4%. Công thức của X là
A. (H2N)2C3H5COOH
B. H2NC2C2H3(COOH)2
C. H2NC3H6COOH
D. H2NC3H5(COOH)2
Cho 200ml dung dịch CuSO4 2M tác dụng vừa đủ với 200ml dung dịch NaOH thu được kết tủa A
a) Viết PTHH và tính nồng độ mol lít của dung dịch NaOH
b) Tính khối lượng kết tủa A
c) Cho kết tủa A nung ở nhiệt độ cao thu được 8g CuO.Tính hiệu suất của phản ứng
CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4 (1)
nCuSO4=0,4(mol)
Theo PTHH 1 ta có:
nNaOH=2nCuSO4=0,8(mol)
nCu(OH)2=nCuSO4=0,4(mol)
CM dd NaOH=\(\dfrac{0,8}{0,2}=4M\)
mCu(OH)2=98.0,4=39,2(g)
Cu(OH)2 -> CuO + H2O (2)
nCuO thực tế=0,1(mol)
Theo PTHH 2 ta có:
nCuO lý thuyết=nCu(OH)2=0,4(mol)
=>H=\(\dfrac{0,1}{0,4}.100\%=25\%\)
Đúng 0
Bình luận (0)
\(n_{CuSO_4}=0,2.2=0,4mol\)
CuSO4+2NaOH\(\rightarrow\)Cu(OH)2\(\downarrow\)+Na2SO4
\(n_{NaOH}=2n_{CuSO_4}=2.0,4=0,8mol\)
\(C_{M_{NaOH}}=\dfrac{n}{v}=\dfrac{0,8}{0,2}=4M\)
\(n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,4mol\)
\(m_{Cu\left(OH\right)_2}=0,4.98=39,2gam\)
Cu(OH)2\(\overset{t^0}{\rightarrow}\)CuO+H2O
\(n_{Cu\left(OH\right)_2\left(pu\right)}=n_{CuO\left(tt\right)}=\dfrac{m}{M}=\dfrac{8}{80}=0,1mol\)
\(\rightarrow H\)=\(\dfrac{0,1}{0,4}.100=25\%\)
Đúng 0
Bình luận (2)
Hỗn hợp E gồm các este đều có công thức phân tử C8H8O2 và chứa vòng bezen. Cho 0,08 mol hỗn hợp E tác dụng vừa đủ với dung dịch KOH, đun nóng. Sau phản ứng, thu được dung dịch X và 3,18 gam hỗn hợp ancol Y. Cho toàn bộ lượng Y tác dụng với lượng Na dư thu được 0,448 lít H2 ở đktc. Cô cạn dung dịch X được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn. Gía trị của m là A. 13,70. B. 11,78. C. 12,18. D. 11,46.
Đọc tiếp
Hỗn hợp E gồm các este đều có công thức phân tử C8H8O2 và chứa vòng bezen. Cho 0,08 mol hỗn hợp E tác dụng vừa đủ với dung dịch KOH, đun nóng. Sau phản ứng, thu được dung dịch X và 3,18 gam hỗn hợp ancol Y. Cho toàn bộ lượng Y tác dụng với lượng Na dư thu được 0,448 lít H2 ở đktc. Cô cạn dung dịch X được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn. Gía trị của m là
A. 13,70.
B. 11,78.
C. 12,18.
D. 11,46.
Chọn A.
Ta có: n Y = n H 2 = 0 , 04 m o l mol
=> E gồm các este của ancol (0,04) và các este của phenol (0,08 – 0,04 = 0,04)
mà n H 2 O = n este của phenol = 0,04 mol và n K O H = n este của ancol + 2neste của phenol = 0,12 mol
→ B T K L m E + m K O H = m muối + m ancol + m H 2 O Þ m muối = 13,7 gam
Đúng 0
Bình luận (0)
Hỗn hợp E gồm các este đều có công thức phân tử C8H8O2 và chứa vòng bezen. Cho 0,08 mol hỗn hợp E tác dụng vừa đủ với dung dịch KOH, đun nóng. Sau phản ứng, thu được dung dịch X và 3,18 gam hỗn hợp ancol Y. Cho toàn bộ lượng Y tác dụng với lượng Na dư thu được 0,448 lít H2 ở đktc. Cô cạn dung dịch X được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn. Gía trị của m là A. 13,70 B. 11,78 C. 12,18 D. 11,46
Đọc tiếp
Hỗn hợp E gồm các este đều có công thức phân tử C8H8O2 và chứa vòng bezen. Cho 0,08 mol hỗn hợp E tác dụng vừa đủ với dung dịch KOH, đun nóng. Sau phản ứng, thu được dung dịch X và 3,18 gam hỗn hợp ancol Y. Cho toàn bộ lượng Y tác dụng với lượng Na dư thu được 0,448 lít H2 ở đktc. Cô cạn dung dịch X được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn. Gía trị của m là
A. 13,70
B. 11,78
C. 12,18
D. 11,46
Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là:
A. 1,2
B. 1,8
C. 2,4
D. 2
Đáp án D
Ta có: n A l C l 3 = 1,5.0,2 = 0,3 mol; n A l ( O H ) 3 = 15 , 6 78 = 0,2 mol
Thể tích NaOH lớn nhất khi kết tủa sinh ra cực đại, bị NaOH hòa tan 1 phần còn 15,6 (g).
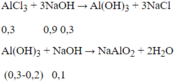
Theo phương trình phản ứng, ta có: nNaOH = 0,9 + 0,1 = 1 mol
⇒VNaOH = 1/0,5 = 2 lít
Đúng 0
Bình luận (0)