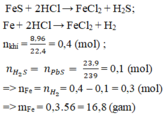Cho 11,36g hỗn hợp gồm Fe; FeO; Fe2O3; Fe3O4 phản ứng với HNO3 dư thu được 1,34l NO là sản phẩm duy nhất ở đktc và dung dịch X Cô cạn X thì thu được bao nhiêu gam muối khan

Những câu hỏi liên quan
Một hỗn hợp X gồm Mg và Fe, để thu được kim loại Fe từ hỗn hợp (giữ nguyên khối lượng Fe ban đầu), ta cho hỗn hợp X tác dụng lần lượt với lượng dư các dung dịch
Đọc tiếp
Một hỗn hợp X gồm Mg và Fe, để thu được kim loại Fe từ hỗn hợp (giữ nguyên khối lượng Fe ban đầu), ta cho hỗn hợp X tác dụng lần lượt với lượng dư các dung dịch
![]()
![]()
![]()
![]()
Chọn D
Đáp án A sai, vì lượng Fe tạo thành nếu cho tiếp H 2 S O 4 dư vào thì Fe bị hòa tan hết.
Đáp án B sai, vì C u S O 4 sẽ phản ứng hết với Mg và Fe dẫn đến chỉ thu được kim loại Cu.
Đáp án c sai, vì A g N O 3 sẽ phản ứng hết với Mg và Fe dẫn đến chỉ thu được Ag và AgI.
Đáp án D đúng, vì khi Z n 2 + dư loại hết Mg ra thì Zn tiếp tục bị hòa tan bới NaOH thu được Fe
Đúng 0
Bình luận (0)
Cho 28,8g hỗn hợp gồm Fe và S đem đun nóng. Sau phản ứng thu được hỗn hợp Y có tỉ khối với H2 là 9. Tính phần trăm khối lượng Fe trong hỗn hợp ban đầu?
Gọi số mol Fe, S là a, b (mol)
=> 56a + 32b = 28,8 (1)
Do hỗn hợp Y chứa H2S, H2
=> Fe dư, S hết
PTHH: Fe + S --to--> FeS
b<---b------->b
Fe + 2HCl --> FeCl2 + H2
(a-b)------------------->(a-b)
FeS + 2HCl --> FeCl2 + H2S
b------------------------>b
=> \(\overline{M}_Y=\dfrac{2\left(a-b\right)+34b}{a-b+b}=9.2=18\left(g/mol\right)\)
=> a = 2b (2)
(1)(2) => a = 0,4 (mol); b = 0,2 (mol)
\(\%m_{Fe}=\dfrac{0,4.56}{28,8}.100\%=77,78\%\)
Đúng 1
Bình luận (2)
cho hỗn hợp gồm fe và fes tác dụng với dung dịch h2so4 loãng, dư thu được 2,24l hỗn hợp khí ở dktc. hỗn hợp này có tỷ khối hơi so với h2 là 9, % theo số mol của hỗn hợp fe và fes?
cho hỗn hợp gồm fe và fes tác dụng với dung dịch h2so4 loãng, dư thu được 2,24l hỗn hợp khí ở dktc. hỗn hợp này có tỷ khối hơi so với h2 là 9, % theo số mol của hỗn hợp fe và fes?
Gọi số mol H2, H2S là a, b (mol)
\(\left\{{}\begin{matrix}a+b=\dfrac{2,24}{22,4}=0,1\\M=\dfrac{2a+34b}{a+b}=9.2=18\left(g/mol\right)\end{matrix}\right.\)
=> a = 0,05 (mol); b = 0,05 (mol)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,05<-------------------0,05
FeS + 2HCl --> FeCl2 + H2S
0,05<---------------------0,05
=> \(\%n_{Fe}=\%n_{FeS}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
Đúng 2
Bình luận (0)
\(M_{hhkhí}=9.2=18\left(g\text{/}mol\right)\\ n_{hhkhí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{H_2S}}{n_{H_2}}=\dfrac{V_{H_2S}}{V_{H_2}}=\dfrac{34-18}{18-2}=\dfrac{1}{1}\)
\(\rightarrow n_{H_2S}=n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,05<-----------------------0,05
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
0,05<-------------------------0,05
\(\rightarrow\left\{{}\begin{matrix}\%n_{Fe}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\\\%n_{FeS}=100\%-50\%=50\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho 10,62 gam hỗn hợp gồm Fe, Zn vào 800ml dung dịch hỗn hợp X gồm NaNO3 0,45M và H2SO4 0,9M. Đun nóng cho phản ứng xảy ra hoàn toàn thu được dung dịch Y và 3,584 lít khí NO (sản phẩm khử duy nhất, đo ở đktc). Tính % khối lượng Fe trong hỗn hợp ban đầu. A. 63,28% B. 36,72% C. 58,26% D. 41,74%
Đọc tiếp
Cho 10,62 gam hỗn hợp gồm Fe, Zn vào 800ml dung dịch hỗn hợp X gồm NaNO3 0,45M và H2SO4 0,9M. Đun nóng cho phản ứng xảy ra hoàn toàn thu được dung dịch Y và 3,584 lít khí NO (sản phẩm khử duy nhất, đo ở đktc). Tính % khối lượng Fe trong hỗn hợp ban đầu.
A. 63,28%
B. 36,72%
C. 58,26%
D. 41,74%
Số mol NaNO3 = 0,36 mol
số mol H2SO4 = 0,72 mol => số mol H+ = 1,44 mol
Ta có các bán phản ứng:
NO3- + 4H+ + 3e → NO + 2H2O (1)
mol 0,16 ← 4.0,16 0,16.3 ← 0,16
Số mol NO = 0,16 mol => H+ và NO3- dư, kim loại phản ứng hết.
Số mol NO3- phản ứng = 0,16 mol; số mol H+ phản ứng = 0,64 mol
Fe → Fe3+ + 3e(1)
Zn → Zn2+ + 2e(2)
Gọi số mol Fe là x mol, số mol Zn là y mol
Theo khối lượng hỗn hợp ban đầu ta có phương trình
56 x + 65 y = 10,62 (I)
Theo định luật bảo toàn electron ta có phương trình
3x + 2y = 0,16.3 (II)
Giải hệ phương trình (I), (II) ta có: x = 0,12 và y = 0,06 mol
mFe = 0,12.56 = 6,72 g => % mFe = 63,28%
Đúng 0
Bình luận (0)
Cho hỗn hợp X gồm Fe, FeO, Fe3O4, Fe2O3 tan hoàn toàn trong dung dịch HNO3 thu được 0,4 mol Fe(NO3)3 và 5,6 lít hỗn hợp khí gồm NO2 và NO (đktc). Vậy số mol HNO3 đã phản ứng là A. 1,45 mol B. 1,4 mol C. 1,35 mol D. 1,2 mol
Đọc tiếp
Cho hỗn hợp X gồm Fe, FeO, Fe3O4, Fe2O3 tan hoàn toàn trong dung dịch HNO3 thu được 0,4 mol Fe(NO3)3 và 5,6 lít hỗn hợp khí gồm NO2 và NO (đktc). Vậy số mol HNO3 đã phản ứng là
A. 1,45 mol
B. 1,4 mol
C. 1,35 mol
D. 1,2 mol
Chọn đáp án A.
BTNT.N => nHNO3 = 0,4 × 3 + 5,6/22,4 = 1,45 mol.
Đúng 0
Bình luận (0)
Hòa tan hỗn hợp gồm Fe và FeS vào dung dịch HCl dư, thu được 8,96 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch
Pb
NO
3
2
dư thì thu được 23,9 gam kết tủa đen. Khối lượng Fe trong hỗn hợp đầu là A. 11,2 B. 16,8 C. 5,6 D. 8,4
Đọc tiếp
Hòa tan hỗn hợp gồm Fe và FeS vào dung dịch HCl dư, thu được 8,96 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb NO 3 2 dư thì thu được 23,9 gam kết tủa đen. Khối lượng Fe trong hỗn hợp đầu là
A. 11,2
B. 16,8
C. 5,6
D. 8,4
Cho 7,2 gam hỗn ha gồm Fe và FeS tác dụng với dung dịch HCL dư thu được 2.24 lít hỗn hợp khí (ở đktc). Tính số mol của Fe và FeS trong hỗn hợp ban đầu
\(n_{hhkhí\left(H_2,H_2S\right)}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a a
FeS + 2HCl ---> FeCl2 + H2S
b b
Hệ pt \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\Leftrightarrow a=b=0,05\left(mol\right)\)
Đúng 5
Bình luận (0)
Cho 12,9g hỗn hợp gồm Fe,Mg,Zn vào 400ml dd hỗn hợp gồm HCl 1M.H2SO4 2M
Chứng minh sau pư axit dư