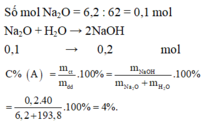Thêm m(g) natri oxit vào 193,8 gam nước được dd M . Tính C% của M

Những câu hỏi liên quan
1. Hoà tan 6,2 g natri oxit vào 193,8 g nước thì được dung dịch A. Tính nồng độ phần trăm của dung dịch A.2. Hoà tan 23,5 g kali oxit vào nước được 0,5 lít dung dịch A. Tính nồng độ mol của dung dịch A.3. Hòa tan hết 12,4 gam natrioxit vào nước thu được 500ml dung dịch A . Tính nồng độ mol của dung dịch A.4. Hòa tan 12,6 gam natri sunfit vào dung dịch axit clohidric dư. Thể tích khí SO2 thu được ở đktc.5. Hòa tan hết 5,6 gam CaO vào dung dịch HCl 14,6% . Tính khối lượng dung...
Đọc tiếp
1. Hoà tan 6,2 g natri oxit vào 193,8 g nước thì được dung dịch A. Tính nồng độ phần trăm của dung dịch A.
2. Hoà tan 23,5 g kali oxit vào nước được 0,5 lít dung dịch A. Tính nồng độ mol của dung dịch A.
3. Hòa tan hết 12,4 gam natrioxit vào nước thu được 500ml dung dịch A . Tính nồng độ mol của dung dịch A.
4. Hòa tan 12,6 gam natri sunfit vào dung dịch axit clohidric dư. Thể tích khí SO2 thu được ở đktc.
5. Hòa tan hết 5,6 gam CaO vào dung dịch HCl 14,6% . Tính khối lượng dung dịch HCl đã dùng.
Cho em xin cách giải chi tiết ạ em cảm ơn :DD
1)
$n_{Na_2O} = \dfrac{6,2}{62} = 0,1(mol)$
$Na_2O + H_2O \to 2NaOH$
$n_{NaOH} = 2n_{Na_2O} = 0,2(mol)$
$m_{dd} = 6,2 + 193,8 = 200(gam) \Rightarrow C\%_{NaOH} = \dfrac{0,2.40}{200}.100\% = 4\%$
2)
$n_{K_2O} = \dfrac{23,5}{94} = 0,25(mol)$
$K_2O + H_2O \to 2KOH$
$n_{KOH} = 2n_{K_2O} = 0,5(mol) \Rightarrow C_{M_{KOH}} = \dfrac{0,5}{0,5} = 1M$
3) $n_{Na_2O} = \dfrac{12,4}{62} = 0,2(mol)$
$Na_2O + H_2O \to 2NaOH$
$n_{NaOH} = 2n_{Na_2O} = 0,4(mol)$
$C_{M_{NaOH}} = \dfrac{0,4}{0,5} =0,8M$
Đúng 3
Bình luận (1)
4)
$Na_2SO_3 + 2HCl \to 2NaCl +S O_2 + H_2O$
Theo PTHH :
$n_{SO_2} = n_{Na_2SO_3} = \dfrac{12,6}{126} = 0,1(mol)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
5) $n_{CaO} = \dfrac{5,6}{56} = 0,1(mol)$
$CaO + 2HCl \to CaCl_2 + H_2O$
Theo PTHH :
$n_{HCl} = 2n_{CaO} = 0,2(mol) \Rightarrow m_{dd\ HCl} = \dfrac{0,2.36,5}{14,6\%} = 50(gam)$
Đúng 3
Bình luận (1)
Bài 1 :
\(n_{Na2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
Pt : \(Na_2O+H_2O\rightarrow2NaOH|\)
1 1 2
0,1 0,2
\(n_{NaOH}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(m_{NaOH}=0,2.40=8\left(g\right)\)
\(m_{ddspu}=6,2+193,8=200\left(g\right)\)
\(C_{ddNaOH}=\dfrac{8.100}{200}=4\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (1)
Xem thêm câu trả lời
Hoà tan 6,2 g natri oxit vào 193,8 g nước thì được dung dịch A. Nồng độ phần trăm của dung dịch A là:
A. 4%.
B. 6%.
C. 4,5%
D. 10%
Thêm m(g) natri oxot vào 193,8 g đc dd M . Tính C% cua M
Câu 8: Hoà tan 6,2 gam natri oxit vào 193,8 gam nước thì được dung dịch X. Nồng độ phần trăm của dung dịch X làA. 4%. B. 6%. C. 4,5%. D. 10%.Câu 9: Hòa tan 14,1 gam K2O vào 41,9 gam nước để tạo một dung dịch có tính kiềm. Nồng độ phần trăm của dung dịch thu được làA. 20%. B. 25%. C. 30%. D. 35%.Câu 10: Một du...
Đọc tiếp
Câu 8: Hoà tan 6,2 gam natri oxit vào 193,8 gam nước thì được dung dịch X. Nồng độ phần trăm của dung dịch X là
A. 4%. B. 6%. C. 4,5%. D. 10%.
Câu 9: Hòa tan 14,1 gam K2O vào 41,9 gam nước để tạo một dung dịch có tính kiềm. Nồng độ phần trăm của dung dịch thu được là
A. 20%. B. 25%. C. 30%. D. 35%.
Câu 10: Một dung dịch axit sunfuric trên thị trường có nồng độ 55%, để có 0,5 mol axit sunfuric thì cần lấy một lượng dung dịch axit sunfuric là
A. 98,1 gam. B. 97,0 gam. C. 47,6 gam. D. 89,1 gam.
Câu 11: Hòa tan 1 mol oleum (H2SO4.3SO3) vào 1000 gam H2O, thu được dung dịch H2SO4 có nồng độ là
A. 15%. B. 27,5%. C. 29,3%. D. 42,25%.
● Mức độ vận dụng
Câu 12: Hòa tan 14,2 gam P2O5 vào m gam dung dịch H3PO4 35%, thu được dung dịch H3PO4 có nồng độ là 50%. Giá trị của m là
A. 17,99 gam. B. 47,3 gam. C. 83,3 gam. D. 58,26 gam.
Câu 13: Hòa tan 142 gam P2O5 vào 500 gam dung dịch H3PO4 24,5%. Nồng độ phần trăm của H3PO4 trong dung dịch thu được là
A. 49,61%. B. 56,32%. C. 48,86%. D. 68,75%.
Câu 14: Cho 38,7 gam oleum H2SO4.2SO3 vào 100 gam dung dịch H2SO4 30%, thu được dung dịch X. Nồng độ phần trăm của H2SO4 trong X là
A. 67,77%. B. 53,43%. C. 74,10%. D. 32,23%.
Câu 15: Hoà tan 67,6 gam oleum H2SO4.xSO3 vào nước thu được dung dịch X. Sau đó cho từ từ một lượng dư BaCl2 vào X thấy có 186,4 gam kết tủa trắng. Công thức của oleum là
A. H2SO4.SO3. B. H2SO4.2SO3. C. H2SO4.3SO3. D. H2SO4.4SO3.
Câu 16: Cho 0,1 mol một loại hợp chất oleum vào nước thu được 2,0 lít dung dịch X. Để trung hoà 1 lít dung dịch X cần dùng 400 ml dung dịch KOH 1M. Phần trăm về khối lượng của nguyên tố lưu huỳnh trong oleum trên là
A. 35,96%. B. 37,21%. C. 37,87%. D. 38,28%.
cho x gam Natri hoặc y gam Natri Oxit vào m gam nước đều thu được dung dịch Natri Oxit nồng độ a%
Lập biểu thức liên hệ giữa x , y , m
Câu 2: Hòa tan 6,2 gam natri oxit vào 193,8 gam nước được dung dịch A. Cho A tác dụng với 300 gam dung dịch CuSO4 16%. Lọc kết tủa, rửa sạch, đem nung đến khối lượng không đổi, thu được m gam chất rắn màu đen. Giá trị của m là:
A. 29,4 gam B. 14,7 gam C. 9,8 gam D. 19,6 gam
Câu 3: Cho 10,6 g Na2CO3 tác dụng với 150g dd H2SO4 9,8% thu được dd X. Tính nồng độ % các chất có trong X?
A. 18,2% và 6,2% B. 9,09% và 3,14% C. 9,5% và 3,1% D. 9,1% và 6,2%
Câu 4: Để trung hoà 200ml...
Đọc tiếp
Câu 2: Hòa tan 6,2 gam natri oxit vào 193,8 gam nước được dung dịch A. Cho A tác dụng với 300 gam dung dịch CuSO4 16%. Lọc kết tủa, rửa sạch, đem nung đến khối lượng không đổi, thu được m gam chất rắn màu đen. Giá trị của m là:
A. 29,4 gam B. 14,7 gam C. 9,8 gam D. 19,6 gam
Câu 3: Cho 10,6 g Na2CO3 tác dụng với 150g dd H2SO4 9,8% thu được dd X. Tính nồng độ % các chất có trong X?
A. 18,2% và 6,2% B. 9,09% và 3,14% C. 9,5% và 3,1% D. 9,1% và 6,2%
Câu 4: Để trung hoà 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là:
A. 250 ml B. 400 ml C. 350 ml D. 300ml
Câu 2: Hòa tan 6,2 gam natri oxit vào 193,8 gam nước được dung dịch A. Cho A tác dụng với 300 gam dung dịch CuSO4 16%. Lọc kết tủa, rửa sạch, đem nung đến khối lượng không đổi, thu được m gam chất rắn màu đen. Giá trị của m là:
A. 29,4 gam B. 14,7 gam C. 9,8 gam D. 19,6 gam
giải thích
Na2O+H2O→2NaOH
0,1____ 0,1____0,2
2NaOH+CuSO4->Na2SO4+Cu(OH)2
0,2______ 0,1______ 0,1_____0,1
.mCu(OH)2=0,1.98=9,8(g)
câu 4
Câu 4: Để trung hoà 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là: A. 250 ml B. 400 ml C. 350 ml D. 300ml
giải thích
Ba(OH)2 + 2HCl →→BaCl2 + 2H2O (1)
Ba(OH)2 + H2SO4 →→BaSO4 + 2H2O (2)
nHCl=0,2.0,3=0,06(mol)
nH2SO4=0,2.0,1=0,02(mol)
Theo PTHH 1 và 2 ta có:
1212nHCl=nBa(OH)2=0,03(mol)
nBa(OH)2=nH2SO4=0,02(mol)
∑nBa(OH)2=0,03+0,02=0,05(mol)
V dd Ba(OH)2=0,05\0,2=0,25(lít)
hòa tan 155g natri oxit vào nước ta được 0,5 l dd , tính nồng độ mol
nồng độ phần trăm .Biết khối lượng riêng của dd 1,1 g/mol
$n_{Na_2O} = \dfrac{155}{62} = 2,5(mol)$
$Na_2O + H_2O \to 2NaOH$
$n_{NaOH} = 2n_{Na_2O} = 2,5.2 = 5(mol)$
$m_{dd} = D.V = 1,1.0,5.1000 = 550(gam)$
$C\%_{NaOH} = \dfrac{5.40}{550}.100\% = 36,36\%$
Đúng 3
Bình luận (0)
Câu 2: Hòa tan 6,2 gam natri oxit vào 193,8 gam nước được dung dịch A. Cho A tác dụng với 300 gam dung dịch CuSO4 16%. Lọc kết tủa, rửa sạch, đem nung đến khối lượng không đổi, thu được m gam chất rắn màu đen. Giá trị của m là:
A. 29,4 gam B. 14,7 gam
C. 9,8 gam D. 19,6 gam
Câu 3: Cho 10,6 g Na2CO3 tác dụng với 150g dd H2SO4 9,8% thu được dd X. Tính nồng độ % các chất có trong X?
A. 18,2% và 6,2%
B. 9,09% và 3,14%
C. 9,5% và 3,1%
D. 9,1% và 6,2%
Câu 4: Để tr...
Đọc tiếp
Câu 2: Hòa tan 6,2 gam natri oxit vào 193,8 gam nước được dung dịch A. Cho A tác dụng với 300 gam dung dịch CuSO4 16%. Lọc kết tủa, rửa sạch, đem nung đến khối lượng không đổi, thu được m gam chất rắn màu đen. Giá trị của m là:
A. 29,4 gam B. 14,7 gam
C. 9,8 gam D. 19,6 gam
Câu 3: Cho 10,6 g Na2CO3 tác dụng với 150g dd H2SO4 9,8% thu được dd X. Tính nồng độ % các chất có trong X?
A. 18,2% và 6,2%
B. 9,09% và 3,14%
C. 9,5% và 3,1%
D. 9,1% và 6,2%
Câu 4: Để trung hoà 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là:
A. 250 ml B. 400 ml C. 350 ml D. 300ml
Bài 2:
\(n_{Na2O}=\frac{6,2}{62}=0,1\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,1_______________0,2
\(n_{CuSO4}=\frac{300.16\%}{160}=0,3\)
\(PTHH:CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
Trước_____ 0,3_______0,2________________
Phản ứng__0,1______0,2____________
Sau_______ 0,2____ 0 _________ 0,1
\(Cu\left(OH\right)_2\rightarrow CuO+H_2O\)
0,1 __________0,1
\(\rightarrow m=0,1.80=8\left(g\right)\)
Bài 3:
\(n_{Na2CO3}=\frac{10,6}{160}=0,1\left(mol\right)\)
\(n_{H2SO4}=\frac{150.9,8\%}{98}=0,15\left(mol\right)\)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
\(n_{H2SO4_{du}}=0,15-0,1=0,05\left(mol\right)\)
\(n_{CO2}=n_{Na2CO3}=0,1\left(mol\right)\)
\(m_{dd_{spu}}=10,6+150-0,144=156,2\left(g\right)\)
\(C\%_{H2SO4}=\frac{0,05.98}{156,2}.100\%=3,14\%\)
\(C\%_{Na2SO4}=\frac{0,1.142}{156,2}.100\%=9,09\%\)
Bài 4:
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\left(1\right)\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\left(2\right)\)
Theo ptpu, ta có:
\(n_{Ba\left(OH\right)2\left(1\right)}=\frac{1}{2}n_{HCl}=0,03\left(mol\right)\)
\(n_{Ba\left(OH\right)2\left(2\right)}=n_{H2SO4}=0,02\left(mol\right)\)
\(n_{Ba\left(OH\right)2_{can}}=n_{Ba\left(OH\right)2\left(1\right)}+n_{Ba\left(OH\right)2\left(2\right)}=0,05\left(mol\right)\)
\(\rightarrow V_{Ba\left(OH\right)2_{Can}}=\frac{0,05}{0,2}=0,25l=250\left(ml\right)\)
Cho 36g hh X gồm 2 oxit của kim loại Natri và Canxi trộn theo tỉ lệ số mol tương ứng 2: 1.
a) Tính thành phần % khối lượng hh X.
b) Hoà tan hết hh X vào 214g nước được dd Y. Tính C% và nồng độ M của dd Y, biết khối lượng riêng ddY là 1,08g/ml.