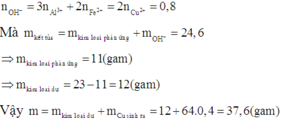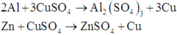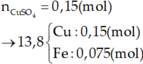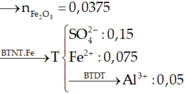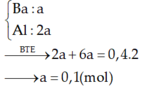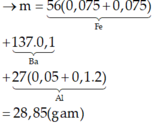Cho 1,572 gam hỗn hợp A dạng bột gồm Al , Fe , Cu tác dụng hoàn toàn với 40ml dung dịch CuSO4 1M thu được dung dịch B và hỗn hợp D gồm 2 kim loại. Cho dung dịch NaOH tác dụng từ từ với dung dịch B đến khi thu được kết tủa lớn nhất, lọc tách kết tủa, nung trong không khí đến khối lượng không đổi thu được 1,82 hỗn hợp hai oxit. Cho D tác dụng hoàn toàn với dung dịch AgNO3 thì lượng Ag thu được lớn hơn khối lượng của D là 7,336 gam. Tính khối lượng của mỗi kim loại trong hỗn hợp A.