xác định công thức muối ngậm nước CuSO4 .n.H2O trong đó Cu chiếm 25,6%

Những câu hỏi liên quan
Trong muối ngâm nước CuSO4 trong đó Cu chiếm 25,6% . Xác định ct của muối ngậm nước
Đặt công thức của muối ngậm nước cần tìm là \(CuSO_4.nH_2O\)
Theo đề, Cu chiếm 25,6%
Ta có: \(\dfrac{64.100}{160+18n}=25,6\)
\(<=> 6400 = 4096+460,8n\)
\(<=> n = 5\)
Vậy công thức muối ngậm nước cần tìm là \(CuSO_4.5H_2O\)
Đúng 0
Bình luận (0)
Trong muối đồng sunfat ngậm nước CuSO4.nH2O lượng cu chiếm 25,6%. Tìm n
\(M_{CuSO4.nH2O}=25,6.64=250\)
\(M_{\left(H2O\right)n}=250-160=90\left(\frac{g}{mol}\right)\)
\(\Rightarrow n=\frac{90}{18}=5\)
một muối sunfat của kim loại hóa trị (2) để lâu ngày trong không khí trở thành phân tủ muối ngậm nước.Trong phân tử muối ngậm nước kim loại chiếm 25,6 phần trăm.Tìm công thức phân tử muối ngậm nước đá
Gọi công thức phân tử ngậm nước là: \(RSO_4.nH_2O\)
Đề bài quá mơ hồ . Phiền em xem lại đề bài rồi
Đúng 1
Bình luận (5)
\(CT:RSO_4\cdot nH_2O\)
\(\%R=\dfrac{R}{R+96+18n}\cdot100\%=25.6\%\)
\(\Leftrightarrow R+96+18n=2.90625R\)
\(\Leftrightarrow2.90625R-18n-96=0\)
\(BL:\)
\(n=5\Rightarrow R=64\)
\(CT:CuSO_4\cdot5H_2O\)
Chúc em học tốt !!
Đúng 2
Bình luận (3)
Bài này quá dễ ,nếu em không làm đc thì nên ra khỏi đội bồi dưỡng hóa em nhé!
Đúng 0
Bình luận (1)
Trong tự nhiên Cu có 2 đồng vị là "Cu và Cu, trong đó Cu chiếm 73%
a. Xác định số khối A của đồng vị thứ 2. Biết nguyên tử khối trung bình của Cu là 63,54.
b. Tính % khối lượng của 6 Cu trong phân tử muối ngậm nước CUSO4.5H2O.
A là công thức phân tử của tinh thể ngậm nước CuSO4.nH2O trong đó chứa 36% lượng nước kết tinh.
a) Xác định công thức phân tử của A?
b) cần bao nhiêu g tinh thể A và bao nhiêu g tinh thể CuSO4 8% để khi trộn vào nhau thì thu được 280g dd CuSO4 16%
A là công thức phân tử của tinh thể ngậm nước CuSO4.nH2O trong đó chứa 36% lượng nước kết tinh.
a) Xác định công thức phân tử của A?
b) cần bao nhiêu g tinh thể A và bao nhiêu g tinh thể CuSO4 8% để khi trộn vào nhau thì thu được 280g dd CuSO4 16%
Một muối ngậm nước có công thức là MgX2.nH2O (X là nguyên tố chưa biết, n là số tự nhiên; 5 ≤ n ≤ 8). Biết %Mg = 11,82%.
a/ Hãy xác định công thức hóa học của muối ngậm nước trên.
b/ Tính % khối lượng của X trong tinh thể.
c/ Tính khối lượng H3PO4 có chứa lượng H bằng lượng H có trong 40,6 gam tinh thể trên
a) \(\%Mg=\dfrac{24}{24+2.M_X+18n}.100\%=11,82\%\)
=> MX + 9n = 89,523
Xét n = 5 => MX = 44,5 (Loại)
Xét n = 6 => MX = 35,5 => X là Cl
Xét n = 7 => MX = 26,5 (Loại)
Xét n = 8 => MX = 17,5 (loại)
Vậy CTHH của tinh thể là MgCl2.6H2O
b) \(\%Cl=\dfrac{35,5.2}{203}.100\%=34,975\%\)
c) \(n_{MgCl_2.6H_2O}=\dfrac{40,6}{203}=0,02\left(mol\right)\)
=> nH = 0,02.12 = 0,24 (mol)
=> \(n_{H_3PO_4}=\dfrac{0,24}{3}=0,08\left(mol\right)\)
=> mH3PO4 = 0,08.98 = 7,84 (g)
Đúng 4
Bình luận (0)
Cho 37,5 mL dung dịch NaOH 0,20 M thật chậm vào 50,00 mL dung dịch CuSO4 0,1 M, tất cả ion đồng và hyđroxit trong dung dịch chuyển sang dạng kết tủa Cux(OH)y(SO4)z. (a) Xác định tỉ lệ x:y:z trong Cux(OH)y(SO4)z. (b) Xác định chất còn lại trong dung dịch sau khi tạo thành kết tủa và nồng độ mol tương ứng. Cho rằng thể tích của kết tủa không đáng kể. (c) Thực tế kết tủa là muối ngậm nước [Cux(OH)y(SO4)z.nH2O]. Khi đun nóng hợp chất này trong điều kiện không có không khí, nhận thấy chất bay hơi chỉ...
Đọc tiếp
Cho 37,5 mL dung dịch NaOH 0,20 M thật chậm vào 50,00 mL dung dịch CuSO4 0,1 M, tất cả ion đồng và hyđroxit trong dung dịch chuyển sang dạng kết tủa Cux(OH)y(SO4)z.
(a) Xác định tỉ lệ x:y:z trong Cux(OH)y(SO4)z.
(b) Xác định chất còn lại trong dung dịch sau khi tạo thành kết tủa và nồng độ mol tương ứng. Cho rằng thể tích của kết tủa không đáng kể.
(c) Thực tế kết tủa là muối ngậm nước [Cux(OH)y(SO4)z.nH2O]. Khi đun nóng hợp chất này trong điều kiện không có không khí, nhận thấy chất bay hơi chỉ là nước và khối lượng chất rắn còn lại 81,63% so với khối lượng chất rắn ban đầu. Xác định công thức đúng của muối ngậm nước.
(a)
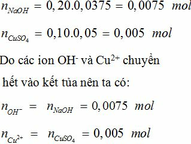

(b) Chất còn lại trong dung dịch sau khi kết tủa là Na2SO4.
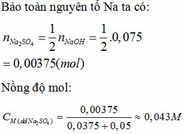
(c)
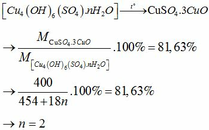
Đúng 0
Bình luận (0)
Bài 1:Tìm x,y trong công thức x.CuSO4.yH2O, biết trong phân tử muối ngậm nước này CuSO4 chiếm 47,05% về khối lượng
Bài 2: Tìm x trong công thức Na2CO3.x.H2O, biết trong phân tử muối ngậm nước này Na2CO3 chiếm 37,07% veed khối lượng
Giúp mình với mình cần gấp !! huhu
1.
=>\(\%m_{CuSO_4}=\dfrac{160x}{160x+18y}.100=47,05\%\)
=>16000x=7528x+846,9y
=>8472x=846,9y
=>10x=y
=>\(\dfrac{x}{y}=\dfrac{1}{10}\)
=>CTHH :\(CuSO_4.10H_2O\) (ct này có vấn đề )
Đúng 0
Bình luận (0)

























