Để tác dụng hoàn toàn với 200 ml dung dịch MgCl\(_2\) 1M,cần một thể tích dung dịch NaOH 2M là
Cho 200 ml dung dịch NaOH 0,5M tác dụng với với 300 ml dung dịch HCl 1M . Muốn phản ứng trung hòa hoàn toàn thì phải thêm dung dịch NaOH 0,5M hay HCl 1M với thể tích là bao nhiêu ?
Hợp chất X có công thức phân tử C H 8 O 3 N 2 . Cho 9,6 gam X tác dụng với 300 ml dung dịch NaOH 1M đun nóng đến phản ứng hoàn toàn được dung dịch Y. Để tác dụng với các chất trong Y cần tối thiểu 200 ml dung dịch HCl a (mol/l) được dung dịch Z. Biết Z không tác dụng với dung dịch B a ( O H ) 2 . Giá trị của a là
A. 1,5
B. 1
C. 0,75
D. 0,5
Cho 200 ml dung dịch CH3COOH 2M tác dụng hoàn toàn và vừa đủ với 100 ml dung dịch NaOH. Tính nồng độ mol của dung dịch NaOH
CH3COOH+NaOH->CH3COONa+H2O
0,4---------------0,4
n CH3COOH=0,4 mol
=>CM NaOH=\(\dfrac{0,4}{0,1}=4M\)
Cho m gam axit aminoaxetic tác dụng vừa đủ với 200 ml dung dịch HCl 1M thu được dung dịch X. Để phản ứng hoàn toàn với các chất tan trong X cần 160 gam dung dịch NaOH 10%. Cô cạn dung dịch thu được chất rắn khan có khối lượng là
A. 19,4 gam.
B. 11,7 gam.
C. 31,1 gam.
D. 26,7 gam.
Chọn đáp án C
Quy quá trình về: Gly + 0,2 mol HCl + NaOH vừa đủ.
nNaOH = 160 × 0,1 ÷ 40 = 0,4 mol ⇒ nGly = 0,4 - 0,2 = 0,2 mol.
► Rắn khan gồm 0,2 mol Gly-Na và 0,2 mol NaCl.
||⇒ mrắn = 0,2 × 97 + 0,2 × 58,5 = 31,1(g) ⇒ chọn C.
Cho m gam axit aminoaxetic tác dụng vừa đủ với 200 ml dung dịch HCl 1M thu được dung dịch X. Để phản ứng hoàn toàn với các chất tan trong X cần 160 gam dung dịch NaOH 10%. Cô cạn dung dịch thu được chất rắn khan có khối lượng là
A. 19,4 gam.
B. 11,7 gam
C. 31,1 gam.
D. 26,7 gam.
Đáp án C
n HCl = 0,2 mol và n NaOH = 0,4 mol
Theo PTHH => n NaCl = n HCl = 0,2 mol
Theo PTHH => n Gly = 0,4 – 0,2 = 0,2 mol
=> Muối chứa 0,2 mol NaCl và 0,2 mol NH2 – CH2- COONa
=> m muối = 0,2 . ( 58,5 + 75 + 22 ) = 31,1 g
Cho m gam axit aminoaxetic tác dụng vừa đủ với 200 ml dung dịch HCl 1M thu được dung dịch X. Để phản ứng hoàn toàn với các chất tan trong X cần 160 gam dung dịch NaOH 10%. Cô cạn dung dịch thu được chất rắn khan có khối lượng là
A. 19,4 gam.
B. 11,7 gam.
C. 31,1 gam.
D. 26,7 gam.
Chọn đáp án C
Quy quá trình về: Gly + 0,2 mol HCl + NaOH vừa đủ.
nNaOH = 160 × 0,1 ÷ 40 = 0,4 mol ⇒ nGly = 0,4 - 0,2 = 0,2 mol.
► Rắn khan gồm 0,2 mol Gly-Na và 0,2 mol NaCl.
||⇒ mrắn = 0,2 × 97 + 0,2 × 58,5 = 31,1(g) ⇒ chọn C.
||⇒ mmuối của axit cacboxylic = 6,62 - 0,03 × 116 = 3,14(g) ⇒ chọn A.
Cho m gam axit aminoaxetic tác dụng vừa đủ với 200 ml dung dịch HCl 1M thu được dung dịch X. Để phản ứng hoàn toàn với các chất tan trong X cần 160 gam dung dịch NaOH 10%. Cô cạn dung dịch thu được chất rắn khan có khối lượng là
A. 19,4 gam.
B. 11,7 gam.
C. 31,1 gam.
D. 26,7 gam
Chọn đáp án C
Quy quá trình về: Gly + 0,2 mol HCl + NaOH vừa đủ.
nNaOH = 160 × 0,1 ÷ 40 = 0,4 mol ⇒ nGly = 0,4 - 0,2 = 0,2 mol.
► Rắn khan gồm 0,2 mol Gly-Na và 0,2 mol NaCl.
||⇒ mrắn = 0,2 × 97 + 0,2 × 58,5 = 31,1(g) ⇒ chọn C.
Cho 15 gam axit aminoaxetic tác dụng vừa đủ với 200 ml dung dịch HCl 1M thu được dung dịch X. Để phản ứng hoàn toàn với các chất tan trong X cần 160 gam dung dịch NaOH 10%. Cô cạn dung dịch thu được chất rắn khan có khối lượng là:
A. 31,1 g.
B. 19,4 g.
C. 26,7 g.
D. 11,7g.
Quy dung dịch X thành hỗn hợp aminoaxit (a mol) và HC1 (0,2 mol)
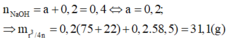
Đáp án A
Câu 2: Cho 200 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là bao nhiêu?
Câu 7: Trung hoà 100 ml dung dịch H2SO4 1M bằng V ml dung dịch NaOH 1M. Tính giá trị của V.
Câu 8: Để trung hòa hết 700 ml dung dịch H2SO4 0,5M cần V ml thể tích dung dịch KOH 12% (D = 1,15 g/ml). Tính giá trị của V.
Câu 10: Trộn 400 gam dung dịch KOH 5,6% với 300 gam dung dịch CuSO4 16%. Tính khối lượng kết tủa tạo thành.
Câu 11: Cho 100 ml dung dịch BaCl2 1M tác dụng vừa đủ 100 ml dung dịch K2CO3. Tính nồng độ mol của chất tan trong dung dịch thu được sau phản ứng.
Câu 12. Viết PTHH hoàn thành dãy chuyển hóa sau
a) Cu -> CuO -> CuCl2 -> Cu(OH)2 -> CuO -> CuSO4 -> Cu.
b) MgSO4 -> Mg(OH)2 -> MgO -> MgCl2 -> Mg(NO3)2 ->MgCO3 -> MgO.
c) Na -> NaOH -> NaCl -> Cl2 -> HCl -> FeCl2 -> Fe(OH)2 -> FeO
d) Fe -> FeCl3 -> Fe(OH)3 -> Fe2O3 -> Fe -> FeCl2 -> Fe(OH)2 -> FeSO4
-> FeCl2 -> Fe(NO3)2 -> Fe.
e) Al -> Al2O3 -> AlCl3 -> Al2(SO4)3 -> Al(OH)3 -> Al(NO3)3 -> Al -> AlCl3
Câu 7 :
\(n_{H2SO4}=0,1.1=0,1\left(mol\right)\)
Pt : \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(n_{NaOH}=2n_{H2SO4}=2.0,1=0,2\left(mol\right)\Rightarrow V_{ddNaOH}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)
Câu 8 :
\(n_{H2SO4}=0,5.0,7=0,35\left(mol\right)\)
Pt : \(H_2SO_4+2KOH\rightarrow K_2SO_4+H_2O\)
\(n_{KOH}=2n_{H2SO4}=2.0,35=0,7\left(mol\right)\)
\(\Rightarrow m_{ddKOH}=\dfrac{0,7.56}{12\%}.100\%=326,67\left(g\right)\)
\(\Rightarrow V_{ddKOH}=\dfrac{326,67}{1,15}=284,06\left(ml\right)\)
Câu 12 :
a) \(2Cu+O_2\xrightarrow[]{t^o}2CuO\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(CuSO_4+Fe\rightarrow FeSO_4+Cu\downarrow\)
b) \(MgSO_4+2KOH\rightarrow Mg\left(OH\right)_2+K_2SO_4\)
\(Mg\left(OH\right)_2\xrightarrow[]{t^o}MgO+H_2O\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(MgCl_2+2AgNO_3\rightarrow Mg\left(NO_3\right)_2+2AgCl\)
\(Mg\left(NO_3\right)_2+Na_2CO_3\rightarrow MgCO_3+2NaNO_3\)
\(MgCO_3\xrightarrow[]{t^o}MgO+CO_2\)
c) \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(NaOH=HCl\rightarrow NaCl+H_2O\)
\(2NaCl+2H_2O\xrightarrow[cmn]{đpdd}2NaOH+H_2+Cl_2\)
\(Cl_2+H_2\xrightarrow[]{as}2HCl\)
\(HCl+Fe\rightarrow FeCl_2+H_2\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(Fe\left(OH\right)_2+H_2SO_4\rightarrow FeSO_4+2H_2O\)
\(FeSO_4+BaCl_2\rightarrow FeCl_2+BaSO_4\)
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(Fe\left(NO_3\right)_2+Mg\rightarrow Mg\left(NO_3\right)_2+Fe\)
e) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Al_2\left(SO_4\right)_3+6KOH\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+3HNO_3\rightarrow Al\left(NO_3\right)_3+3H_2O\)
\(Al\left(NO_3\right)_2+Mg\rightarrow Mg\left(NO_3\right)_2+Âl\)
\(2Al+3Cl_2\xrightarrow[]{t^o}2AlCl_3\)
Bạn xem đề chỗ AlCl3 ra Al2(SO4)3 nhé
Câu 10 :
\(n_{KOH}=\dfrac{5,6\%.400}{100\%.56}=0,4\left(mol\right)\)
\(n_{CuSO4}=\dfrac{16\%.300}{100\%.160}=0,3\left(mol\right)\)
Pt : \(2KOH+CuSO_4\rightarrow K_2SO_4+Cu\left(OH\right)_2\)
0,4 0,3 0,2
Xét tỉ lệ : \(\dfrac{0,4}{2}< \dfrac{0,3}{1}\Rightarrow CuSO_4dư\)
\(\Rightarrow m_{kt}=m_{Cu\left(OH\right)2}=0,2.98=19,6\left(g\right)\)
Câu 11 :
\(n_{BaCl2}=0,1.1=0,1\left(mol\right)\)
Pt : \(BaCl_2+K_2CO_3\rightarrow BaCO_3+2KCl\)
\(n_{KCl}=2n_{BaCl2}=2.0,1=0,2\left(mol\right)\Rightarrow C_{MKCl}=\dfrac{0,2}{0,1+0,1}=1M\)