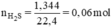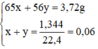Ngâm 45,5g hỗn hợp bột các kim loại : Zn,Cu,Ag trong dung dịch HCl dư thu được 4,48l khí (đktc). Nếu nung 1 lượng hỗn hợp như trên trong không khí , phản ứng xog thu được hỗn hợp rắn mới có khối lượng là 51,9 g.
a,Viết PTPƯ
b, Tính thành phần % theo khối lượng có trong hỗn hợp ban đầu