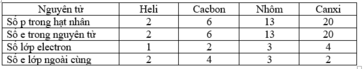
so sánh về số p trong hạt nhân, số e trong nguyên tử và số e lớp ngoài cùng.

Những câu hỏi liên quan
Cho biết sơ đồ một số nguyên tử sau:

Hãy chỉ ra : số p trong hạt nhân, số e trong nguyên tử, số lớp electron và số e lớp ngoài cùng của mỗi nguyên tử.
Cho biết sơ đồ một số nguyên tử sau: Hãy chỉ ra: Số p trong hạt nhân, số e trong nguyên tử, số lớp electron và số e lớp ngoài cùng của mỗi nguyên tử. Trong nguyên tử, electron chuyển động và sắp xếp như thế nào?
Đọc tiếp
Cho biết sơ đồ một số nguyên tử sau:
Hãy chỉ ra: Số p trong hạt nhân, số e trong nguyên tử, số lớp electron và số e lớp ngoài cùng của mỗi nguyên tử. 
Trong nguyên tử, electron chuyển động và sắp xếp như thế nào?
| Nguyên tử | Số p trong hạt nhân | Số e trong nguyên tử | Số e lớp ngoài cùng | Số lớp electron |
| He | 2 | 2 | 2 | 1 |
| C | 6 | 6 | 4 | 2 |
| Al | 13 | 13 | 3 | 3 |
| Ca | 20 | 20 | 2 | 4 |
Đúng 0
Bình luận (0)
1) Nguyên tử nguyên tố X có điện tích hạt nhân là 11+, 3 lớp e, lớp ngoài cùng có 1 e. Hãy suy ra vị trí của X trong bảng tuần hoàn và nêu tính chất hóa học cơ bản của nó. So sánh tính chất hóa học cơ bản của X với nguyên tố Y có số hiệu nguyên tử là 322) Nguyên tố X có số hiệu nguyên tử là 17, chu kỳ 3, nhóm VII trong bảng tuần hoàn các nguyên tố hóa học. Hãy cho biết cấu tạo nguyên tử và tính chất hóa học đặc trưng của X3) Căn cứ vào bảng tuần hoàn các nguyên tố hóa học hãy cho biết:a) Tính ch...
Đọc tiếp
1) Nguyên tử nguyên tố X có điện tích hạt nhân là 11+, 3 lớp e, lớp ngoài cùng có 1 e. Hãy suy ra vị trí của X trong bảng tuần hoàn và nêu tính chất hóa học cơ bản của nó. So sánh tính chất hóa học cơ bản của X với nguyên tố Y có số hiệu nguyên tử là 32
2) Nguyên tố X có số hiệu nguyên tử là 17, chu kỳ 3, nhóm VII trong bảng tuần hoàn các nguyên tố hóa học. Hãy cho biết cấu tạo nguyên tử và tính chất hóa học đặc trưng của X
3) Căn cứ vào bảng tuần hoàn các nguyên tố hóa học hãy cho biết:
a) Tính chất hóa học của Mg và P
b) So sánh TCHH của Mg và P với các nguyên tố lân cận trong chu kỳ, trong nhóm nguyên tố
2. Theo dữ kiện bài ra => X là Cl
- Sơ đồ cấu tạo :
- Clo là một chất có tính oxi hóa mạnh. Trong các hợp chất như NaCl, KCl… Clo thường có mức oxi hóa là -1. Tuy nhiên, clo cũng là một chất có tính khử. Tính khử của clo được thể hiện trong trường hợp tác dụng với Oxi. Các mức oxi hóa của clo thường là +1, +3, +5 hay +7…
- Clo có thể tác dụng với kim loại , hidro , nước , muối gốc halogen yếu hơn , chất có tính khử mạnh ,...
Đúng 1
Bình luận (0)
Câu 1 : Tổng số hạt cơ bản trong nguyên tử Y là 46. Trong hạt nhân của nguyên tử Y số hạt không mang điện nhiều hơn số hạt mang điện 1 đơn vị .
a / Cho biết số hạt mỗi loại trong nguyên tử Y ? Y thuộc nguyên tố nào
b / Tìm số e lớp ngoài cùng và vẽ sơ đồ cấu tạo của nguyên tử Y.
Xem chi tiết
Cho biết tổng số hạt trong nguyên tử X là 28,số hạt ko mang điện là 10
1,Tính số p và số e trong nguyên tử
2,X có bao nhiêu lớp e? Hãy mô tả các lớp e và tìm số e lớp ngoài cùng?
1,
Gọi số p, số e, số n trong nguyên tử X lần lượt là: p, e, n
Vì tổng số hạt trong nguyên tử X là 28
\(\Rightarrow p+e+n=28\)
Mà \(p=e\)
\(\Rightarrow2p+n=28\left(1\right)\)
Vì số hạt không mạng điện là 10
\(\Rightarrow n=10\left(2\right)\)
Ta thay (2) và (1) được:
\(2p+10=28\)
\(\Rightarrow2p=18\)
\(\Rightarrow p=9\)
\(\Rightarrow p=e=9\)
2,
- Trong X có hai lớp e
- Lớp e đầu tiên có hai electron
- Lớp e thứ hai có 7 electron
\(\rightarrow\) Vậy lớp e ngoài cùng có 7 electron
Đúng 1
Bình luận (0)
Xác định cấu tạo nguyên tử số điện tích hạt nhân số e số lớp e số e lớp ngoài cùng của nguyên tố A B C trong các trường hợp sau và giải thích Nguyên tố A có số hiệu nguyên tử 13 thuộc chu kì 3 nhóm IIIANguyên tố B có số hiệu nguyên tử 11 thuộc chu kì 3 nhóm IANguyên tố C có số hiệu nguyên tử 9 số chu kì 2 nhóm VIIA
Đọc tiếp
Xác định cấu tạo nguyên tử số điện tích hạt nhân số e số lớp e số e lớp ngoài cùng của nguyên tố A B C trong các trường hợp sau và giải thích
Nguyên tố A có số hiệu nguyên tử 13 thuộc chu kì 3 nhóm IIIA
Nguyên tố B có số hiệu nguyên tử 11 thuộc chu kì 3 nhóm IA
Nguyên tố C có số hiệu nguyên tử 9 số chu kì 2 nhóm VIIA
Đầu tiên là F fluorine số electon 19 stt 9 chu kì 2 nhóm VIIA
Thứ 2 là sodium số electon 23 stt 11 chu kì 3 nhóm IA
Cuối cùng là scandium số electon là 45 stt 21 chu kì 4 nhóm IIIB
Đúng 1
Bình luận (0)
nguyên tử nguyên tố A có khối lượng 40 đ.v.C, trong hạt nhân có số p= n. Nguyên tử nguyên tố B có khối lượng 16 đ.v.C, có số lớp e ngoài cùng là 6. Tìm p, n, e
Bài 4: Tổng các hạt trong nhuyên tử nguyên tố A là 80 hạt. Trong đó hạt mang điện nhiều hơn hạt không mang điện là 20 hạt. Tính các hạt trong A
Bài 5: Cho nguyên tử nguyên tố B có số P là 12. Tìm số e, số lớp e, số e lớp ngoài cùng
BÀI 1 :
Gọi số proton,notron,electron của nguyên tử nguyên tố A lần lượt là p,n,e(p,n,eϵN*)
TA CÓ :
p + n + e = 80 => 2p + n = 80 (vì nguyên tử trung hòa về điện) (1)
Do trong nguyên tử nguyên tố A số hạt mang điện lớn hơn số hạt không mang điện là 20 hạt
=> 2p - e = 20
Kết hợp (1) ta được :
2p = 50 => p = 25 (hạt)
=> e = 25 (hạt)
=> n = 30 (hạt)
Vậy số proton , notron , electron của nguyên tử A lần lượt là 25 , 30 , 25 (hạt)
Đúng 0
Bình luận (0)
Bài 2 :
Do nguyên tử nguyên tố B có số hạt proton là 17 (hạt)
=> Số electron trong nguyên tử B là 17 (hạt)
TA CÓ :
17 = 2 + 8 + 7
=> Số lớp electron của nguyên tử nguyên tố A là 3 lớp và số electron lớp ngoài cùng là 7 ( hạt )
Đúng 0
Bình luận (0)
Cho tổng số hạt p,n,e trong nguyên tử X là 36 .số hạt không mang điện chiếm 1/3 tổng số hạt .Tính số hạt p,n,etrong nguyên tử đó. Vẽ sơ đồ cấu tạo nguyên tử X?cho biết số lớp electron và hạt electron lớp ngoài cùng?
Số hạt không mang điện là:
\(\dfrac{1}{3}.36=12\left(hạt\right)\)
\(\Rightarrow p=e=\dfrac{36-12}{2}=12\left(hạt\right)\)
(Bn tự vẽ hình nhé.)
Đúng 1
Bình luận (5)
tổng số hạt p,n,e trong nguyên tử x là 18.Số electron lớp ngoài cùng nguyên tử x là
\(2p+n=18\\ \frac{18}{3,5} \leq p \leq\frac{18}{3}\\ 5,12\leq p\leq 6\\ \Rightarrow p=e=6; n=4 \)
Đúng 1
Bình luận (0)