Một oxit bazơ có %mO-17,7%. Tìm CTHH của oxit biết htrị kim loại là II

Những câu hỏi liên quan
Khử 4,8 gam một oxit kim loại trong dãy điện hóa ở nhiệt độ cao, cần 2,016 lít H2. Kim loại thu được đem hòa tan trong dung dịch HCl, thu được 1,344 lít H2. Biết các khí đo ở đktc. Vậy oxit cần tìm là: A. FeO B. Fe2O3 C. CuO D. Ag2O
Đọc tiếp
Khử 4,8 gam một oxit kim loại trong dãy điện hóa ở nhiệt độ cao, cần 2,016 lít H2. Kim loại thu được đem hòa tan trong dung dịch HCl, thu được 1,344 lít H2. Biết các khí đo ở đktc. Vậy oxit cần tìm là:
A. FeO
B. Fe2O3
C. CuO
D. Ag2O
Đáp án B
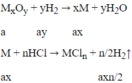
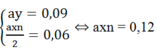
→ ax = 0,12/n
Ta có: (Mx + 16y)a = 4,8
→ Max + 16ay = 4,8 (1)
Thay ay = 0,09 và ax = 0,12/n vào (1)
Ta có: M = 28n → n = 2→ M = 56 : Fe
Thay n = 2 vào ta có: ax = 0,06
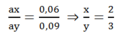
→ Fe2O3
Đúng 0
Bình luận (0)
câu 1 :một oxit kim loại ở mức hóa trị thấp chứa 77,78% kim loại còn lại là oxi , trong oxit của kim loại đó ở mức hóa trị cao thì chứa 70% khối lượng kim loại còn lại là oxi , hỏi đó là kim loại nào?câu 2:nếu hàm lượng phần trăm của 1 kim loại trong oxit là 60% thì trong muối xunfat của kim loại đó hàm lượng phần trăm của kim loại là bao nhiêu ?
Đọc tiếp
câu 1 :
một oxit kim loại ở mức hóa trị thấp chứa 77,78% kim loại còn lại là oxi , trong oxit của kim loại đó ở mức hóa trị cao thì chứa 70% khối lượng kim loại còn lại là oxi , hỏi đó là kim loại nào?
câu 2:
nếu hàm lượng phần trăm của 1 kim loại trong oxit là 60% thì trong muối xunfat của kim loại đó hàm lượng phần trăm của kim loại là bao nhiêu ?
bn nào hok giỏi hóa giúp mình với
Đúng 0
Bình luận (0)
Một nhiệt lượng kế bằng đồng khối lượng
m
1
100
g
c
o
c
h
ư
a
m
2
375
g
nước ở nhiệt độ
25
0
C
. Cho vào nhiệt lượng kế một vật bằng kim loại khối lượng
m
3
400...
Đọc tiếp
Một nhiệt lượng kế bằng đồng khối lượng m 1 = 100 g c o c h ư a m 2 = 375 g nước ở nhiệt độ 25 0 C . Cho vào nhiệt lượng kế một vật bằng kim loại khối lượng m 3 = 400 g ơ 90 0 C . Biết nhiệt độ khi có sự cân bằng nhiệt là 30 0 C . Tìm nhiệt dung riêng của miếng kim loại. Cho biết nhiệt dung riêng của đồng là 380J/Kg.K, của nước là 4200J/Kg.K
A. 336J/kg.K
B. 636J/kg.K
C. 366J/kg.K
D. 633J/kg.K
Gọi t1=250C - nhiệt độ ban đầu của nhiệt lượng kế và nước trong nhiệt lượng kế
t2=900C - nhiệt độ của vật kim loại
t - nhiệt độ khi cân bằng của hệ
Ta có:
Nhiệt lượng mà nhiệt lượng kế và nước thu được:
Q 1 = m 1 c 1 t − t 1
Q 2 = m 2 c 2 t − t 1
=> tổng nhiệt lượng thu vào:
Q 12 = Q 1 + Q 2 = m 1 c 1 + m 2 c 2 t − t 1
Nhiệt lượng mà vật kim loại tỏa ra:
Q 3 = m 3 c 3 . t 2 − t
Theo phương trình cân bằng nhiệt, ta có:
Q 3 = Q 12 ⇔ m 3 c 3 t 2 − t = m 1 c 1 + m 2 c 2 t − t 1 ⇒ c 3 = m 1 c 1 + m 2 c 2 t − t 1 m 3 t 2 − t ⇒ c 3 = 0 , 1.380 + 0 , 375.4200 30 − 25 0 , 4. 90 − 30 ⇒ c 3 = 336 J / k g . K
Đáp án: A
Đúng 0
Bình luận (0)
Cho 5,1 g 1 oxit của kim loại R (III) tan vừa đủ trong 150ml dung dịch H2SO4 1M
a) viết PTHH
b) tìm CTHH của oxit
a) Gọi CTHH của oxit là $R_2O_3$
$R_2O_3 + 3H_2SO_4 \to R_2(SO_4)_3 + 3H_2$
b) $n_{H_2SO_4} = 0,15.1 = 0,15(mol)$
$n_{oxit} =\dfrac{1}{3}n_{H_2SO_4} = 0,05(mol)$
$M_{oxit} = 2R + 16.3 = \dfrac{5,1}{0,05} = 102 \Rightarrow R = 27(Al)$
Vậy oxit là $Al_2O_3$
Đúng 3
Bình luận (0)
Hòa tan oxit của 1 kim loại R hóa trị III bằng dung dịch HCl 18,25% vừa đủ thu được dung dịch A có nồng độ % của mmuối là 23,897%. Xác định cthh của oxit trên.
CHIều nay mìnhcần gấp rồi, giúp mình vs
gọi CTC của oxit là R2O3, đặt số mol R2O3 là 0.1(mol)
R2O3+6HCl-->2RCl3+3H2O
0.1 0.6 0.2 0.3 (mol)
C%ddHCl= 0.6x36.5x100/mdd=18.25
==>mddHCl=120(g)
C%ddspu=0.2x(R+35.5x3)x100/[0.1x(2R+48)+120]=23.897
==> R=56 : Fe
Đúng 0
Bình luận (8)
Hòa tan 2,4g một oxit kim loại hóa trị II cần dùng 30g dung dịch HCl 7,3%
a) viết PTHH
b) xác định công thức của oxit kim loại
Đặt công thức của oxit KL là RO
RO + 2HCl → RCl2 + H2O
Ta có m HCl = (30 .7,3) : 100 = 2,19 g
=> n HCl = 2,19 : 36,5 = 0,06 mol
Từ pt => n RO = nHCl/2 = 0,03
=> 2,4 : (R+16) = 0,03
=> 64 = R
=> R là Cu
=> CT oxit là CuO
Đúng 4
Bình luận (0)
help me!!!!
Một oxit kim loại M chưa rõ hóa trị có tỉ lệ m oxi=3/7%M. Xác định CT của oxit kim loại ns trên
Nếu khó quá thì nên hoc24.vn
Ai đọc rồi thì ấn Đúng 0 nhé
Đúng 0
Bình luận (0)
cái này k dành cho vật lí và hóa học nhé,lên hoc.24.vn mà hỏi
Đúng 0
Bình luận (0)
k phải toán đừng đăng lên bn sẽ bị trừ điểm đấy
Đúng 0
Bình luận (0)
Hòa tan hoàn tan một lượng oxit kim loại hóa trị II vào một lượng vừa đủ H2SO4 a% tạo thành dung dịch muối sunphat có nồng độ b%.
a Xác định khối lượng mol của kim loại theo a% và b%
b Tìm oxit kim loại . Biết a% = 10%, b% = 11,76%
câu 1 : nung 2,45g 1 muối vô cơ thấy thoát ra 0,96g khí oxi phần chất rắn còn lại chứa 52,35% kali và 47,65% clo. Tìm công thức phân tử của muối vô cơ đócâu 2 : có 1 muối nitrat trong đó nguyên tố kim loại chiếm 38,61% khối lượng . vậy trong oxit của kim loại đó thì nó chiếm bao nhiêu phần trăm và đó là kim loại nàobn nào biết thì giúp m nhé!!!!!
Đọc tiếp
câu 1 : nung 2,45g 1 muối vô cơ thấy thoát ra 0,96g khí oxi phần chất rắn còn lại chứa 52,35% kali và 47,65% clo. Tìm công thức phân tử của muối vô cơ đó
câu 2 : có 1 muối nitrat trong đó nguyên tố kim loại chiếm 38,61% khối lượng . vậy trong oxit của kim loại đó thì nó chiếm bao nhiêu phần trăm và đó là kim loại nào
bn nào biết thì giúp m nhé!!!!!![]()

















