Bằng những phương pháp nào có thể chứng minh được thành phần định tính và định lượng của nước? Viết các phương trình hóa học có thể xảy ra?

Những câu hỏi liên quan
Bằng những phương pháp nào có thể chứng minh được thành phần định tính và định lượng của nước? Viết các phương trình hóa học xảy ra?
Bằng phương pháp phân hủy nước bằng dòng điện hoặc tổng hợp nước (thực nghiệm) để chứng minh thành phần định tính và định lượng của nước
PTHH: 2H2O → 2H2 + O2
2H2 + O2 → 2H2O
Đúng 0
Bình luận (0)
Bằng những phương pháp nào có thể chứng minh được thành phần định tính và định lượng của nước? Viết các phương trình hóa học có thể xảy ra?
trong SGK hóa 8 có mà bạn ,bạn chịu khó tìm nha
Đúng 0
Bình luận (0)
Bằng phương pháp hóa học (dùng dòng điện tách nước, đốt bằng tia lửa điện, hay tác dụng với một số kim loại ở nhiệt độ thường) hay phương pháp vật lí (nhiệt độ sôi, hóa rắn thành đá và tuyết), ta có thể chứng minh được thành phần định tính và định lượng của nước. Phương trình hóa học:
\(2H_2O\rightarrow^{t^o}2H_2+O_2\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
Đúng 0
Bình luận (0)
Bằng phương pháp hóa học (dùng dòng điện tách nước, đốt bằng tia lửa điện, hay tác dụng với một số kim loại ở nhiệt độ thường) hay phương pháp vật lí (nhiệt độ sôi, hóa rắn thành đá và tuyết), ta có thể chứng minh được thành phần định tính và định lượng của nước.
PTHH: (1) 2H2O -đp-> 2H2 + O2 (đp: điện phân)
(2) Ca + 2H2O -> Ca(OH)2 + H2
Đúng 0
Bình luận (0)
Bằng phương pháp hoá học nào có thể Xác định được có khí clo lẫn trong khí hiđro clorua ?
Viết PTHH của các phản ứng xảy ra.
Cách 1: Cho hỗn hợp khí đi qua dung dịch HBr hoặc dung dịch HI, Cl 2 sẽ oxi hoá HBr hoặc HI thành Br 2 hoặc I 2 làm cho dung dịch không màu ban đầu chuyển thành màu vàng hoặc màu nâu.
Cl 2 + 2HBr → 2HCl + Br 2 (dung dịch có màu vàng)
hoặc Cl 2 + 2HI → 2HCl + I 2 (dung dịch có màu vàng nâu)
Cách 2: Có thể nhận ra Cl 2 có trong hỗn hợp khí bằng quỳ tím ấm.
Khi cho quỳ tím ẩm vào bình khí nếu quỳ tím ẩm chuyển sang màu đỏ sau đó mất màu đỏ chứng tỏ trong hỗn hợp khí có Cl 2
Đúng 0
Bình luận (0)
Ở nhiệt độ phòng, hỗn hợp khí X gồm hiđrocacbon A và lượng dư hiđro có tỉ khối so với H2 là 3,375. Khi cho X qua Ni đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y có tỉ khối so với H2 là 4,5. a) Xác định công thức phân tử của A. b) Tính thành phần phần trăm theo thể tích của các chất có trong X. Nếu cho X qua Pd/BaSO4 đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z. Trong Z chỉ có hai chất khí là B và hiđro. c) Viết phương trình phản ứng tạo thành B...
Đọc tiếp
Ở nhiệt độ phòng, hỗn hợp khí X gồm hiđrocacbon A và lượng dư hiđro có tỉ khối so với H2 là 3,375. Khi cho X qua Ni đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y có tỉ khối so với H2 là 4,5.
a) Xác định công thức phân tử của A.
b) Tính thành phần phần trăm theo thể tích của các chất có trong X.
Nếu cho X qua Pd/BaSO4 đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z. Trong Z chỉ có hai chất khí là B và hiđro.
c) Viết phương trình phản ứng tạo thành B trên. Tính tỉ khối của Z so với hiđro.
d) B có thể cho phản ứng polime hóa. Viết phương trình phản ứng này.
Hợp chất B cho phản ứng với Cl2 ở 500 tạo thành C (có chứa 46,4% khối lượng Cl). C phản ứng với dung dịch NaOH loãng thu được D. Cho D phản ứng với nước và Cl2 thu được E (có chứa 32,1% khối lượng Cl). Sau cùng E phản ứng với dung dịch NaOH loãng thu được F.
e) Viết công thức cấu tạo của các chất từ B đến F và viết các phương trình hóa học xảy ra
a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
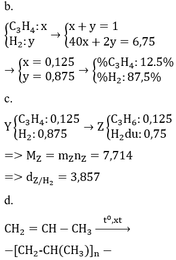

Đúng 0
Bình luận (0)
Những kim loại nào có thể điều chế bằng phương pháp trên từ các oxit X tương ứng sau: MgO, Fe3O4, Al2O3, CuO, CaO? Viết phương trình hóa học minh họa cho các quá trình trên
Những oxit bị khử là: Fe3O4, CuO
Pt: Fe3O4 + 4H2 → 3Fe + 4H2O
CuO + H2 → Cu + H2O
Chú ý: Nhiệt luyện là phương pháp dùng (H2, CO) khử các oxit kim loại trung bình (–K, Na, Ca, Ba, Mg, Al)
Đúng 0
Bình luận (0)
Bằng những phương pháp hóa học nào có thể điều chế Ag từ dung dịch AgNO3, điều chế Mg từ dung dịch MgCl2? Viết các phương trình hóa học.
Các phương pháp điều chế Ag từ AgNO3 là :
- Nhiệt phân :
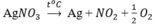
- Thủy luyện :
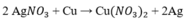
- Điện phân dung dịch :
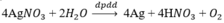
Phương pháp điều chế Mg từ MgCl2 là : điện phân nóng chảy MgCl2
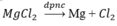
Đúng 0
Bình luận (0)
Hấp thụ hoàn toàn 12,8g SO2 vào 250ml dung dịch NaOH 1M.
Viết các phương trình hóa học của phản ứng có thể xảy ra.
Tính khối lượng muối tạo thành sau phản ứng

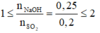 ⇒ phản ứng tạo 2 muối
⇒ phản ứng tạo 2 muối
Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x mol; nNaHSO3 = y mol
nNaOH = 2x + y = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,05, y = 0,15.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,05 x 126 = 6,3g.
Đúng 0
Bình luận (0)
1) Viết phương trình phản ứng điều chế magie sunàt từ Mg(OH)2 và dung dịch axit sunfuric loãng 2) Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Chất nào tác dụng với HCl sinh ta dung dịch không có màu. 3) Viết phương trình hóa học giữa Magie oxit và axit nitric 4) Có 10g hỗn hợp bột hai kim loại Fe và Cu. Hãy nêu phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp theo phương pháp hóa học và vật lý. Viết phương trình hóa học. (Biết Cu ko tác dụng với H...
Đọc tiếp
1) Viết phương trình phản ứng điều chế magie sunàt từ Mg(OH)2 và dung dịch axit sunfuric loãng
2) Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Chất nào tác dụng với HCl sinh ta dung dịch không có màu.
3) Viết phương trình hóa học giữa Magie oxit và axit nitric
4) Có 10g hỗn hợp bột hai kim loại Fe và Cu. Hãy nêu phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp theo phương pháp hóa học và vật lý. Viết phương trình hóa học.
(Biết Cu ko tác dụng với HCl và H2SO4)
Bài 1)
Mg(OH)2 + H2SO4 => MgSO4 + 2H20
Bài 2)
sinh ra dd ko màu thì chỉ có Al2O3 thôi
Bài 3)
MgO + 2HNO3 => Mg(NO3)2 + H2O
Bài 4)
phương pháp hóa học
+ lấy hh Fe, Cu tác dụng với HCl
Fe +2 HCl => FeCl2 + H2
+ còn đồng ko tác dụng dc với HCl : ta lọc đồng ra khỏi hh òi phơi khô. Ta giả định cho đồng là 4g => mFe = 6g
% Cu = 4*100/10 = 40(%)
% Fe = 100- 40= 60 (%)
phương pháp vật lý
dùng nam châm hút sắt ra khỏi hỗn hợp. Ta có mFe là 6g => m Cu = 4 (g)
% Cu = 4*100/10 = 40(%)
% Fe = 100-40 = 60(%)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 4,6 gam rượu etylic trong oxi thu được khí cacbonđioxit và hơi nước. a. Viết phương trình hóa học xảy ra? b. Tính thể tích khí oxi (ở đktc) cần dùng ? c. Tính khối lượng khí cacbonic và khối lượng hơi nước tạo thành?
a) $C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
b) $n_{C_2H_5OH} = \dfrac{4,6}{46} = 0,1(mol)$
$n_{O_2} = 3n_{C_2H_5OH} = 0,3(mol)$
$V_{O_2} = 0,3.22,4 = 6,72(lít)$
c)
Theo PTHH :
$n_{CO_2} = 2n_{C_2H_5OH} = 0,2(mol) \Rightarrow V_{CO_2} = 0,2.22,4 = 4,48(lít)$
$n_{H_2O} = 3n_{C_2H_5OH} = 0,3(mol) \Rightarrow m_{H_2O} = 0,3.18 = 5,4(gam)$
Đúng 2
Bình luận (0)












