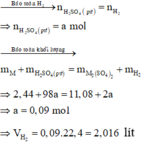Bài 1: Hòa tan hoàn toàn 3.53 g hỗn hợp gồm 3 kim loại Fe, Al, Mg bằng dung dịch thì thu dc 2.352 l khí ở dktc. Cô cạn dung dịch sau phản ứng thu dc m (g) muối khan. Tìm m.
Bài 2: Dẫn hỗn hợp khí A gồm khí và có tỷ khối hơi so với khí H2 là 9.66 qua ống sứ chứa nung nóng. Sau khi phản ứng kết thúc thu dc 16.8 (g) Fe. Tính thể tích từng khí ở đktc trong hỗn hợp A.
Bài 3: a) Hỗn hợp A gồm và có tỷ khối hơi đối với không khí là 2. Tính % về thể tích và khối lượng mỗi khí trong hỗn hợp đó.
b) Trộn 11.2 g Fe với 5,6 g lưu huỳnh rồi đem nung nóng trong môi trường không khí có khí oxi. Khi phản ứng hoàn toàn người ta thu dc những chất nào? Tính khối lượng mỗi chất đó.
Bài 4: Đốt chày hoàn toàn 14,8 g hỗn hợp 2 kim loại Cu và Fe cần 3,36 l khí oxi ( đktc). Tính khối lượng chất rắn thu dc theo 2 cách.
Bài 5: Đốt cháy hoàn toàn 3g các bon trong bình kín chứa khí oxi. Xác định thể tích khí oxi trong bình ở đktc để sau phản ứng trong bình có:
a) một chất khí duy nhấtb) Hỗn hộp 2 chất khí có thể tích bằng nhau
b) hỗn hợp 2 chất khí có thể tích bằng nhau.
Câu 1 (2 điểm): Nguyên tử X có tổng số hạt proton, nơtron và electron là 52.Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16.
a. Tính số hạt mỗi lại của nguyên tử X
b. Cho biết số electron tron mỗi lớp của nguyên tử X
c. Tìm nguyên tử khối của X, biết mp ≈ mn ≈1,013 đvC
d. Tính khối lượng bằng gam của X, biết khối lượng của 1 nguyên tử C là 1,9926 x 10-23 và C= 12 đvC