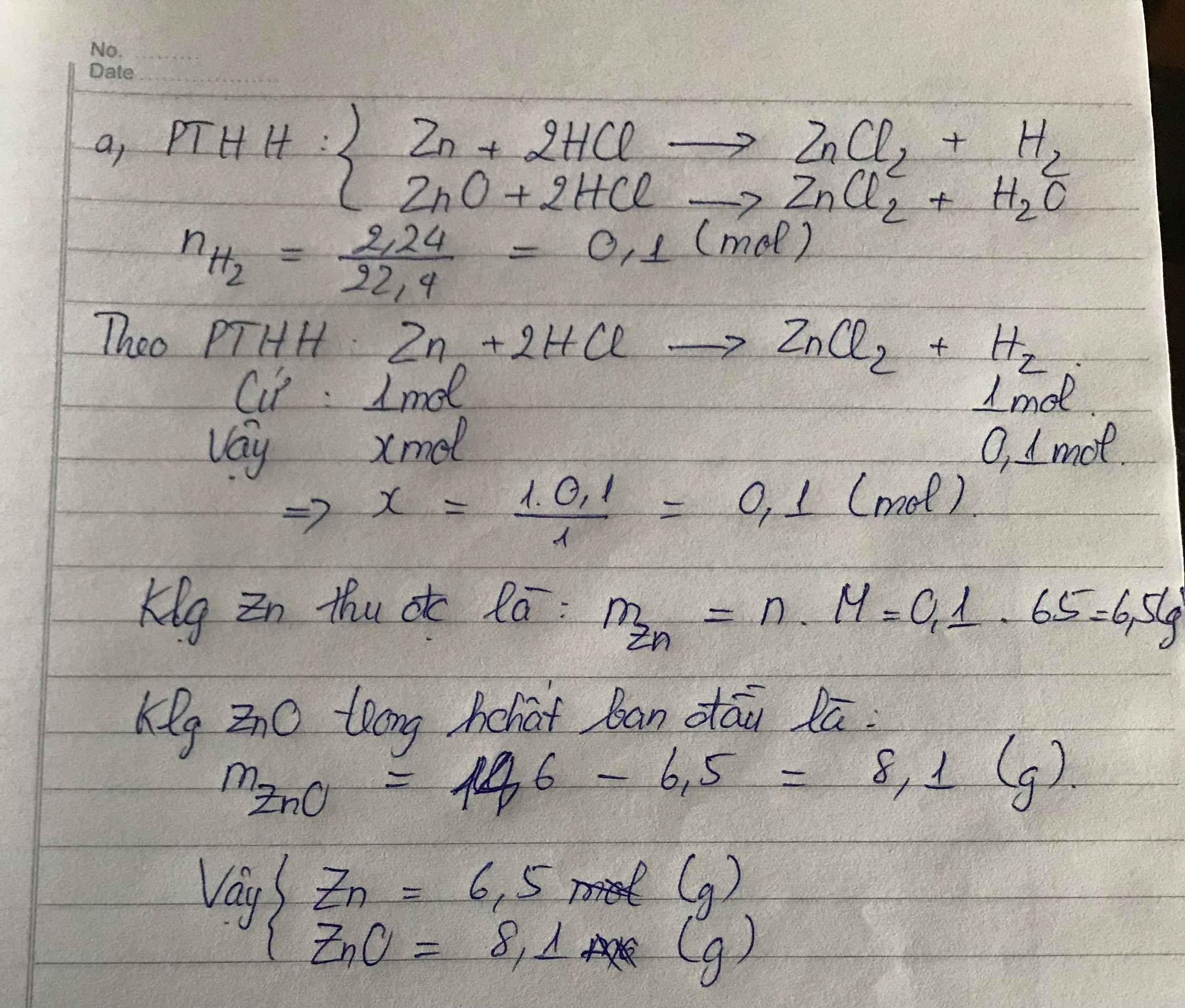Cho 9,6 g hỗn hợp gồm Ca và CaO hòa tan hết vào nước, thu được 2,24 lít H2 ở đktc.
a, Viết các PTHH xảy ra và cho biết thuộc loại phản ứng gì.
b, Tính tp% mỗi chất trong hỗn hợp.
c, Tính kl Ca(OH)2 thu đc

Những câu hỏi liên quan
Cho 9,6 gam hỗn hợp gồm Ca và CaO hòa tan hết vào nước, thu được 2,24 lít khí H 2 (đktc).
Viết phản ứng xảy ra.
Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp ban đầu.
Tính khối lượng C a ( O H ) 2 thu được.
Cho 9,6 gam hỗn hợp gồm Ca và CaO hòa tan hết vào nước, thu được 2,24 lít khí H 2 (đktc).
Viết phản ứng xảy ra.
Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp ban đầu.
Tính khối lượng C a ( O H ) 2 thu được.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH:
Ca + 2H2O ---> Ca(OH)2 + H2
0,1<-------------0,1<---------0,1
=> \(\left\{{}\begin{matrix}m_{Ca}=0,1.40=4\left(g\right)\\m_{CaO}=9,6-4=5,6\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Ca}=\dfrac{4}{9,6}.100\%=41,67\%\\\%m_{CaO}=100\%-41,67\%=58,33\%\end{matrix}\right.\)
\(n_{CaO}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: CaO + H2O ---> Ca(OH)2
0,1------------------>0,1
=> \(m_{Ca\left(OH\right)_2}=\left(0,1+0,1\right).74=14,8\left(g\right)\)
Đúng 4
Bình luận (0)
Hòa tan 4,4 gam hỗn hợp gồm Mg vag MgO bằng một lượng dd H2SO4 loãng có nồng độ 19,6%, sau phản ứng, thu được 2,24 lít khí H2(ở đktc)
a) Viết PTHH của các phản ứng xảy ra?
b) Tính kl mỗi chất có trong hỗn hợp ban đầu
c) Tính kl dd H2SO4 cần dùng để hòa tan hỗn hợp
a, \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
b, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Mg}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Mg}=0,1.24=2,4\left(g\right)\)
\(\Rightarrow m_{MgO}=4,4-2,4=2\left(g\right)\)
c, \(n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{Mg}+n_{MgO}=0,15\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,15.98=14,7\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{14,7}{19,6\%}=75\left(g\right)\)
Đúng 2
Bình luận (0)
Hòa tan hỗn hợp có khối lượng 9,6g gồm Ca và CaO vào nước, thu được 2,24 lit khí hidro
a, Viết phương trình phản ứng
b, Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp ban đầu
c, Tính khối lượng Ca(OH)2 thu được
giúp minh nhé các bạn ! ^_^ !
a. PTHH:
\(Ca+2H_2O--->Ca\left(OH\right)_2+H_2\left(1\right)\)
\(CaO+H_2O--->Ca\left(OH\right)_2\left(2\right)\)
b. Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT(1): \(n_{Ca}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Ca}=0,1.40=4\left(g\right)\)
\(\Rightarrow\%_{m_{Ca}}=\dfrac{4}{9,6}.100\%=41,7\%\)
\(\%_{m_{CaO}}=100\%-41,7\%=58,3\%\)
c. Ta có: \(n_{CaO}=\dfrac{9,6-4}{56}=0,1\left(mol\right)\)
Ta có: \(n_{hh}=0,1+0,1=0,2\left(mol\right)\)
Theo PT(1,2): \(n_{Ca\left(OH\right)_2}=n_{hh}=0,2\left(mol\right)\)
\(\Rightarrow m_{Ca\left(OH\right)_2}=0,2.74=14,8\left(g\right)\)
Đúng 2
Bình luận (0)
a) Ca+2H2O→Ca(OH)2+H2
0,1 0,1 0,1 mol
CaO+H2O→Ca(OH)2
0,1 0,1 mol
b)nH2=2,24/22,4=0,1 mol
mCa=0,1.40=4 g
%mCa=4/9,6 .100%=41,6 %
%mCaO=100%-41,6%=58,4%
c)mCaO=9,6-4=5,6 g
nCaO=5,6/56= 0,1 mol
mCa(OH)2=0,1.148=14,8 g
Đúng 0
Bình luận (0)
6, Hòa tan hỗn hợp có khối lượng 9,6g gồm Ca và CaO vào nước, thu được 2,24 lit khí hidro
a, Viết phương trình phản ứng
b, Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp ban đầu
c, Tính khối lượng Ca(OH)2 thu được
https://hoc24.vn/cau-hoi/hoa-tan-hon-hop-co-khoi-luong-96g-gom-ca-va-cao-vao-nuoc-thu-duoc-224-lit-khi-hidroa-viet-phuong-trinh-phan-ungb-tinh-thanh-phan-phan-tram-theo-khoi-luong-moi-chat-trong-hon-hop-ban-dauc-tinh-kh.3272147582242
Đúng 0
Bình luận (0)
Hòa tan 14,6g hỗn hợp gồm Zn, ZnO vào dd HCL vừa đủ. Sau phản ứng thu được 2,24 lít khí ở đktc
a) Viết các PTHH xảy ra
b)Tính khối lượng mỗi chất có trong hỗn hợp ban đầu.
Xin giúp em nhanh với mn ạ!!!
cho 9,6 gam hỗn hợp gồm Ca và CaO hoà tan hết vào nước, người ta thu được 2,24 lít khí H2 ở (đktc). khối lượng của Ca trong hỗn hợp trên là bao nhiêu?
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Theo PT: \(n_{Ca}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Ca}=0,1.40=4\left(g\right)\)
Đúng 1
Bình luận (0)
maitruonggiang
Ta có: nH2= 2,24/22,4 = 0,1 (mol)
PTHH: Ca + 2H2O → Ca(OH2 + H2↑ (1)
(mol) 0,1 0,1 ← 0,1
CaO + H2O Ca(OH)2 (2)
Tính phần trăm khối lượng:
Từ (1) → nH2= nCa= 0,1 (mol) → mCa = 0,1 x 40 = 4 (gam)
Vậy %mCa = 4/9,6 x 100% = 41,667%;
%mCaO = 100% - 41,667% = 58,333%
mCaO = 9,6 – 4 = 5,6 (g) → nCaO = 5,6/56 = 0,1 (mol)
Từ (1) và (2) → nCa(OH)2 =0,1+ 0,1 = 0,2 (mol)
→ mCa(OH)2= 0,2 x 74 = 14,8 (gam).
Học tốt
Đúng 1
Bình luận (0)
Hòa tan 10g hỗn hợp bột gồm Fe và Cu trong hcl dư. Đến khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí A, Viết Pthh của các phản ứng xảy ra B, tính thành phần phần trăm theo khối lượng của các kim loại trong hỗn hợp ban đầu
a)
$Fe + 2HCl \to FeCl_2 + H_2$
b)
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$\%m_{Fe} = \dfrac{0,1.56}{10}.100\% = 56\%$
$\%m_{Cu} = 100\% -56\% = 44\%$
Đúng 5
Bình luận (0)
Cho 9,6g hỗn hợp gồm Ca và Cao hòa tan hết vào nước, thu được 2,24 lít khí H2 ( đktc)
a) Viết PTHH xảy ra
b) tính thành phần % theo khối lượng mỗi chất trong hỗn hợp ban đầu
c) tính khối lượng Ca(OH)2 thu được
a) Ca + 2H2O → Ca(OH)2 + H2↑ (1)
CaO + H2O → Ca(OH)2 (2)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
b) Theo Pt1: \(n_{Ca}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Ca}=0,1\times40=4\left(g\right)\)
\(\Rightarrow m_{CaO}=9,6-4=5,6\left(g\right)\)
\(\Rightarrow\%Ca=\dfrac{4}{9,6}\times100\%=41,67\%\)
\(\%CaO=\dfrac{5,6}{9,6}\times100\%=58,33\%\)
b) Theo PT1: \(n_{Ca\left(OH\right)_2}=n_{H_2}=0,1\left(mol\right)\)
\(n_{CaO}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PT2: \(n_{Ca\left(OH\right)_2}=n_{CaO}=0,1\left(mol\right)\)
\(\Rightarrow\Sigma n_{Ca\left(OH\right)_2}=0,1+0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{Ca\left(OH\right)_2}=0,2\times74=14,8\left(g\right)\)
Đúng 0
Bình luận (0)