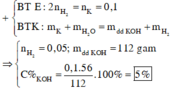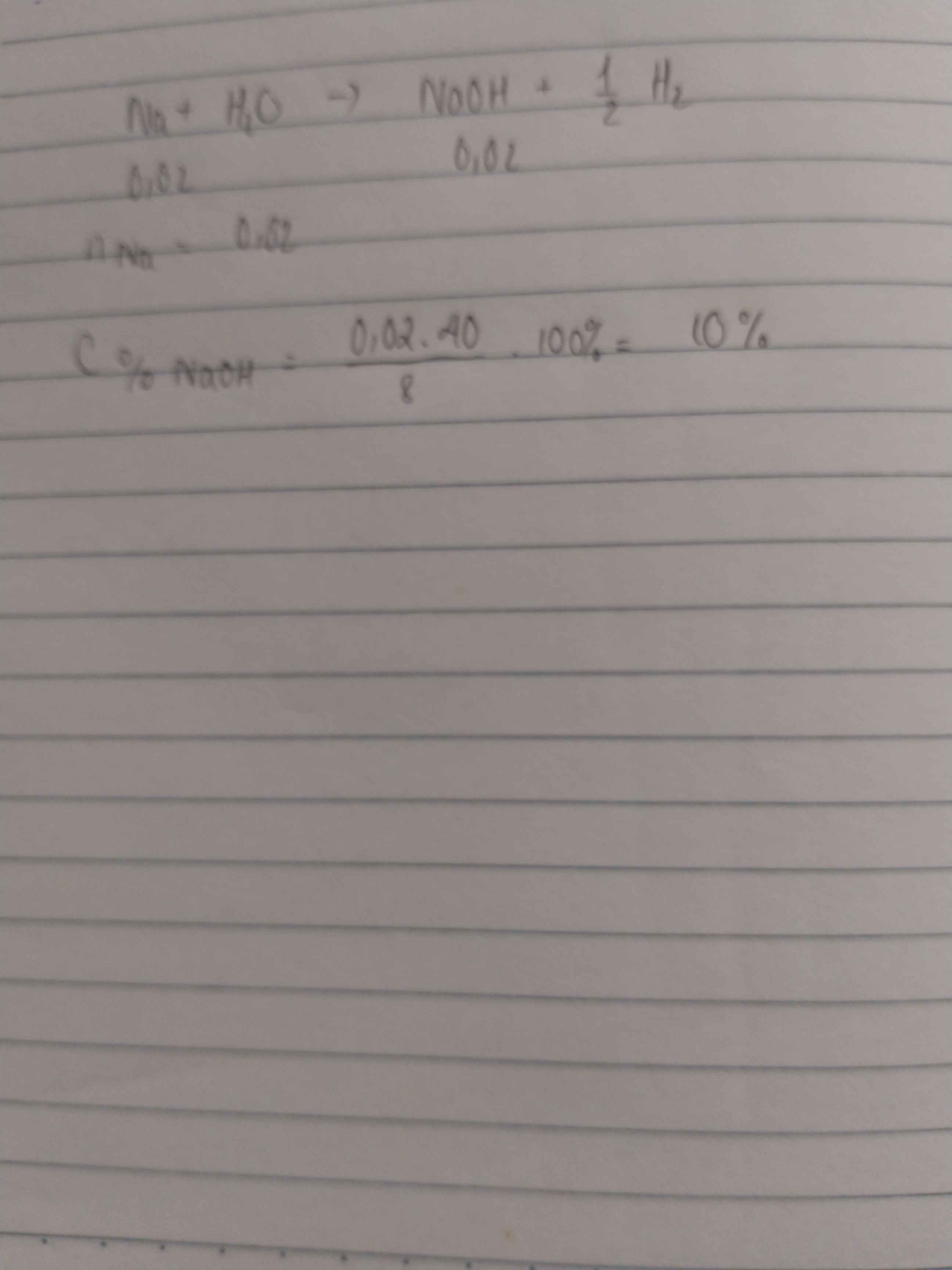Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là ?

Những câu hỏi liên quan
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam Kali tác dụng với 108,2 gam H 2 O là
A. 5,00%.
B. 6,00%.
C. 4,99%.
D. 4,00%.
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là A. 5,00%. B. 6,00%. C. 4,99%. D. 4,00%.
Đọc tiếp
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là
A. 5,00%.
B. 6,00%.
C. 4,99%.
D. 4,00%.
:Cho 0,46 gam natri tác dụng với 8 gam H2O tạo thành dung dịch A. Tính nồng độ phần trăm của chất tan thu được dung dịch A
2) Cho 3,9 gam K tác dụng hoàn toàn với 96,2 gam nước. Tính thể tích khí thu được ở (đktc) và nồng độ phần trăm của dung dịch bazơ (KOH) tạo thành sau phản ứng?
Ta có : \(n_K=\dfrac{m}{M}=\dfrac{3,9}{39}=0,1\) (mol)
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{96,2}{18}=5,34\)(mol)
Phương trình hóa học :
2K + 2H2O ---> 2KOH + H2
2 : 2 : 2 : 1
Nhận thấy \(\dfrac{n_K}{n_{H_2O}}=\dfrac{0,1}{5,34}< \dfrac{2}{2}\)
=> Kali hết , nước dư
=> \(n_{H_2}=\dfrac{n_K}{2}=0,05\) (mol)
=> Thể tích khí H2 : V = n.22,4 = 0,05.22,4 = 1,12(l)
Lại có \(n_{KOH}=0,1\) (mol) => \(m_{KOH}=0,1.56=5,6\) (g)
\(m_{H_2}=0,05.2=0,1\left(g\right)\)
Nồng độ phần trăm của Base thu được :
\(C\%=\dfrac{m_{KOH}}{m_{dd}-m_{H_2}}=\dfrac{5,6}{96,2+3,9-0,1}=0,056=5,6\%\)
Đúng 1
Bình luận (0)
Cho 3,9 gam Kali tác dụng với 101,8 gam nước. C% của dung dịch thu được là
A. 3,8%
B. 5,3%
C. 5,5%
D. 5,2%
Hòa tan hoàn toàn 3,9 gam Kali vào 36,2 gam nước thu được V (lít) , khí H2(ở đktc) và dung dịch A. a tính V. b tính nồng độ phần trăm của dung dịch A
a)
$2K + 2H_2O \to 2KOH + H_2$
b)
n K = 3,9/39 = 0,1(mol)
Theo PTHH :
n H2 = 1/2 n K = 0,05(mol)
=> V H2 = 0,05.22,4 = 1,12(lít)
c)
m dd sau pư = m K + m nước - m H2 = 3,9 + 36,2 - 0,05.2 = 40(gam)
C% KOH = 0,1.56/40 .100% =14%
Đúng 1
Bình luận (0)
Cho 23 gam Na tác dụng với 100 gam nước. Nồng độ phần trăm của dung dịch thu được là
A. 23,8%.
B. 30,8%.
C. 32,8%.
D. 29,8%.
Đáp án C
Ta có phản ứng:
2Na + 2H2 → 2NaOH + H2↑.
+ Ta có nNa = 1 mol ⇒ nH2 = 0,5 mol
⇒ mH2 = 0,5×2 = 1 gam.
⇒ mDung dịch sau phản ứng = 23 + 100 – 1 = 122 gam.
+ Ta có nNaOH = 1 mol ⇒ mNaOH = 40 gam.
⇒ C%NaOH = 40 122 × 100 ≈ 32,8%
Đúng 0
Bình luận (0)
Cho 23 gam Na tác dụng với 100 gam nước. Nồng độ phần trăm của dung dịch thu được là
A. 23,8%.
B. 30,8%.
C. 32,8%.
D. 29,8%.
Đáp án C
Ta có phản ứng: 2Na + 2H2 → 2NaOH + H2↑.
+ Ta có nNa = 1 mol ⇒ nH2 = 0,5 mol
⇒ mH2 = 0,5×2 = 1 gam.
⇒ mDung dịch sau phản ứng = 23 + 100 – 1 = 122 gam.
+ Ta có nNaOH = 1 mol ⇒ mNaOH = 40 gam.
⇒ C%NaOH = 40 122 × 100 ≈ 32,8%
Đúng 0
Bình luận (0)
Bài 13: Cho một hỗn hợp chứa 4,6 g natri và 3,9 g kali tác dụng với nước .
a) Tính thể tích khí hiđro thu được (đktc ) ?
b) Tính nồng độ phần trăm của dung dịch biết khối lượng nước là 91,5 g?
Bài 14: Ở 20o C, khi hòa tan 60 gam KNO3 vào 190 nước thì thu được dung dịch bão hòa. Tính độ tan của KNO3 ở nhiệt độ đó?
Bài 13: nNa= 0,2 mol ; nK= 0,1 mol
2Na + 2H2O → 2NaOH + H2↑
0,2 mol 0,2 mol 0,1 mol
2K + 2H2O → 2KOH + H2↑
0,1 mol 0,1 mol 0,05 mol
a) tổng số mol khí H2 là: nH2= 0,1 + 0,05 = 0,15 mol
→VH2= 0,15 x 22,4 = 3,36 (l)
b) mNaOH= 0,2 x 40= 8 (g) ; mKOH= 0,1 x 56= 5,6 (g)
mdung dịch= mNa + mK + mH2O - mH2 = 4,6 + 3,9 + 91,5 - 0,15x2 = 99,7 (g)
→C%NaOH= 8/99,7 x100%= 8,02%
→C%KOH= 5,6/99,7 x100%= 5,62%
Đúng 0
Bình luận (3)