1,10 g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 g bột lưu huỳnh : a) Viết phương trình hóa học của phản ứng đã xảy ra ; b) tính tỉ lệ phần trăm của sắt và nhôm trong khối lượng ban đầu theo lượng chất và khối lượng chất .

Những câu hỏi liên quan
1,10 g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 g bột lưu huỳnh : a) Viết phương trình hóa học của phản ứng đã xảy ra ; b) tính tỉ lệ phần trăm của sắt và nhôm trong khối lượng ban đầu theo lượng chất và khối lượng chất .
1,10 g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 g bột lưu huỳnh : a) Viết phương trình hóa học của phản ứng đã xảy ra ; b) tính tỉ lệ phần trăm của sắt và nhôm trong khối lượng ban đầu theo lượng chất và khối lượng chất .
a. Fe + S \(\rightarrow\) FeS
2Al + 3S \(\rightarrow\) Al2S3
b. Gọi x, y lần lượt là số mol của sắt và nhôm ta có:
PT: Fe + S \(\rightarrow\) FeS
theo đề x(mol) x(mol)
2Al + 3S \(\rightarrow\) Al2S3
y(mol) (3/2)y (mol)
Theo đề bài ta có hệ: 56x + 27y = 1,1
x + (3/2)y = 1,28/32= 0.04
Giải hệ ta được x= 0.01; y=0.02
KHối lượng sắt trong hỗn hợp là:56x = 56x0.01=0.56 g
+> %Fe=(0.56/1.1)x100%= 50.9%
=> %Al= 100% - 50.9% = 49,1%
Đúng 1
Bình luận (0)
1,10 g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 g bột lưu huỳnh : a) Viết phương trình hóa học của phản ứng đã xảy ra ; b) tính tỉ lệ phần trăm của sắt và nhôm trong khối lượng ban đầu theo lượng chất và khối lượng chất .
Cho 1,10 gam hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 gam bột lưu huỳnh. Viết PTHH của các phản ứng đã xảy ra.
1,10g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
Viết các phương trình hóa học của phản ứng xảy ra.
Phương trình hóa học của phản ứng
Fe + S → FeS
2Al + 3S → Al2S3
Đúng 0
Bình luận (0)
1,10g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu, theo :
- Lượng chất.
- Khối lượng chất.
a)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có (mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl = %.
%mFe = 50,91 %.
Theo lượng chất :
%nAl = 66,67%.
%Fe = 33,33%.
Đúng 0
Bình luận (0)
)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có
(mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl =
%.
%mFe = 50,91 %.
Theo lượng chất :
Đúng 0
Bình luận (0)
Cho 1,10 gam hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 gam bột lưu huỳnh.
Tính tỉ lệ % của sắt và nhôm trong hỗn hợp ban đầu theo :
+ Lượng chất (số mol).
+ Khối lượng chất (số gam).
Fe + S → FeS
x x (mol)
2Al + 3S → t ° Al 2 S 3
y 3y/2(mol)
Đặt số mol Fe, Al lần lượt là x,y ta có hệ phương trình:
56x + 27y = 1,1
(x +3y/2).32 = 1,28
Giải ra x = 0,01 và y = 0,02
% n Fe = 0,01/0,03 x 100% = 33,33%; % n Al = 100 - 33,33% = 66,667%
% m Fe = 56.0,01/1,1 x 100% = 50,90%; % m Al = 100 - 50,90 = 49,1 (%)
Đúng 0
Bình luận (0)
1,10g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
Tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu, theo:
- lượng chất.
- khối lượng chất.
Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = 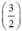 . nAl =
. nAl = 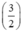 . y mol
. y mol
⇒ nS = x + 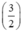 . y = 0,04 mol.
. y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
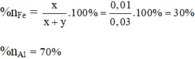
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = 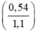 × 100% = 49,09%
× 100% = 49,09%
%mFe = 100% - 49,09% = 50,91%
Đúng 1
Bình luận (0)
1,10g hỗn hợp bột Fe và bột Al tác dụng vừa đủ với 1,28 g bột lưu huỳnh
a) Viết phương trình hóa học xảy ra
b) Tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu theo lượng chất và khối lượng chất
Giúp mình với !! Mình đang cần gấp
\(Fe+S\rightarrow FeS\) (1)
a-----a-------a---------(mol)
\(2Al+3S\rightarrow Al_2S_3\) (2)
b------1,5b----0,5b-----(mol)
Ta có hệ PT sau:
\(\left\{{}\begin{matrix}56a+27b=1,1\\32a+48b=1,28\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\)
=> mFe=0,01.56=0,56gam
mAl=0,02.27=0,54gam
\(\%Fe=\dfrac{0,56}{1,1}.100\%\approx51\%=>\%Al=100-51=49\%\)
vậy...
Đúng 0
Bình luận (1)
Ta có : \(n_S=\dfrac{m}{M}=\dfrac{1,28}{32}=0,04\left(mol\right)\)
Gọi x, y lần lượt là số mol của Fe và Al trong hỗn hợp
\(\Rightarrow m_{Fe}+m_{Al}=56x+27y=1,10=1,1\left(g\right)\)(1 )
a) PTHH :
Fe + S \(\rightarrow^{t^o}\)FeS
x-----x
2Al + 3S \(\rightarrow^{t^o}Al_2O_3\)
y------1,5y
\(\Rightarrow x+1,5y=0,04\) ( 2 )
Từ ( 1 ) và ( 2 ) , ta có hệ phương trình :
\(\left\{{}\begin{matrix}56x+27y=1,1\\x+1,5y=0,04\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu :
* Theo lượng chất
\(\%n_{Fe}=\dfrac{0,01\cdot100\%}{0,01+0,02}=33,33\%\)
\(\%n_{Al}=\dfrac{0,02\cdot100\%}{0,01+0,02}=66,67\%\)
* Theo khối lượng chất
\(\%m_{Fe}=\dfrac{m_{Fe}\cdot100\%}{m_{hh}}=\dfrac{0,01\cdot56\cdot100\%}{1,1}=51\%\)
\(\%m_{Al}=100\%-\%Fe=100\%-51\%=49\%\)
Mong là đúng
Đúng 0
Bình luận (2)
















