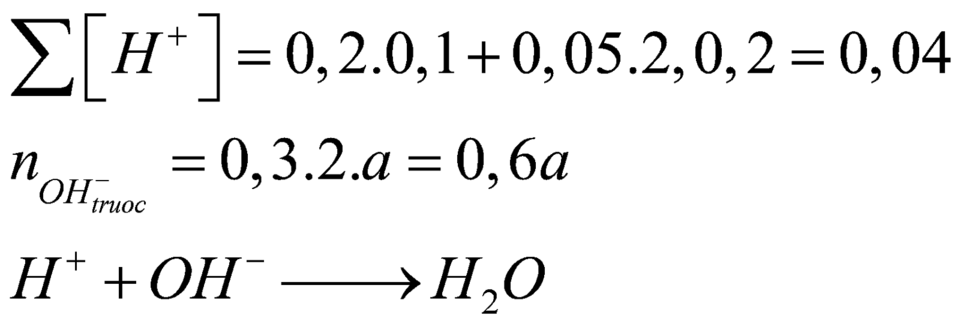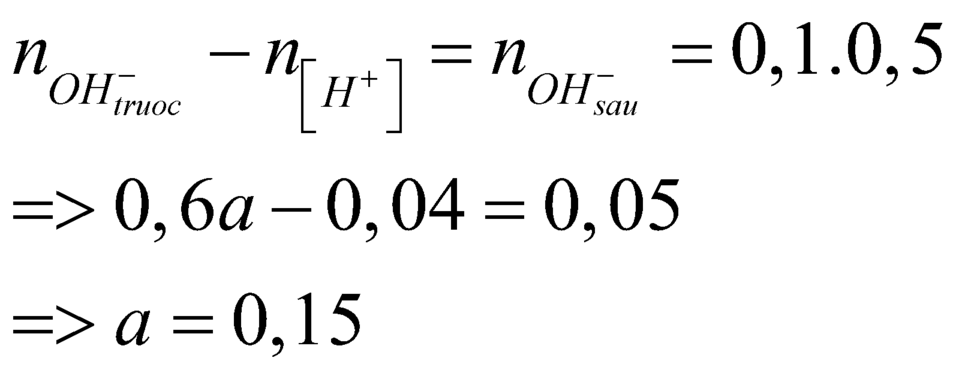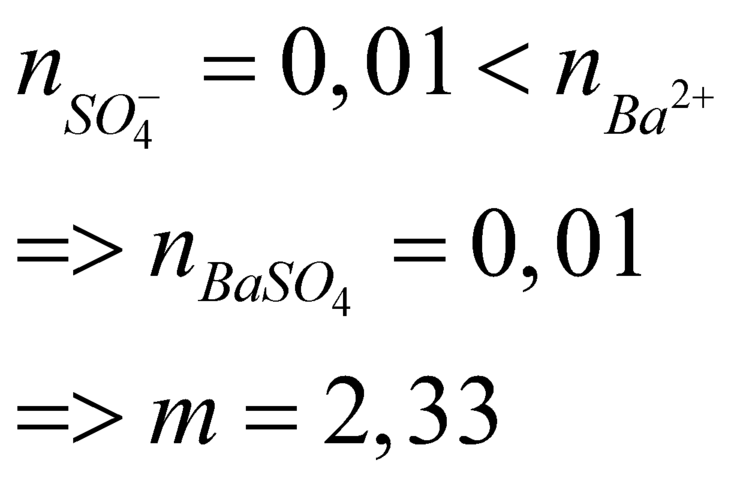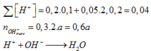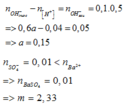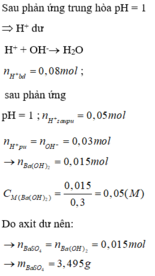Mọi người giải giúp mk vs ạ
Câu 15: Trộn 200 ml dd gồm HCl 0,1M và H2SO4 0,05 M với 300 ml dd Ba(OH)2 a mol/l thu được m gam kết tủa và 500 ml dd có pH=13. Giá trị của a và m tương ứng là
A. 0,15 và 2,33. B. 0,3 và 10,485. C. 0,15 và 10,485. D. 0,3 và 2,33.
Câu 16: Dung dịch X chứa hỗn hợp NaOH 0,25M và Ba(OH)2 0,15M, dung dịch Y chứa hỗn hợp H2SO4 0,5M và HNO3 0,2M. Trộn V lít dung dịch X với V’ lít dung dịch Y, thu được dung dịch Z có pH =3. Tỉ lệ V/V’ là
A. 2,17. B. 1,25. C. 0,46. D. 0,08.
Câu 17: Trộn hai dung dịch H2SO4 0,1M và HCl 0,3M với những thể tích bằng nhau, thu được dung dịch X. Lấy 450 ml dung dịch X cho tác dụng với V lít dung dịch Y gồm NaOH 0,15M và KOH 0,05M, thu được dung dịch Z có pH = 1. Giá trị của V là
A. 0,225. B. 0,155. C. 0,450. D. 0,650.
Câu 18: Trộn lẫn 3 dung dịch H2SO4 0,1M, HNO3 0,2M và HCl 0,3M với những thể tích bằng nhau, thu được dung dịch X. Lấy 300 ml dung dịch X cho phản ứng với V lít dung dịch Y gồm NaOH 0,2M và KOH 0,29M, thu được dung dịch Z có pH = 2. Giá trị V là
A. 0,134 lít. B. 0,214 lít. C. 0,414 lít. D. 0,424 lít.
Câu 19: Dung dịch X thu được khi trộn một thể tích dung dịch H2SO4 0,1M với một thể tích dung dịch HCl 0,2M. Dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M. Đổ 100 ml dung dịch X vào 100 ml dung dịch Y, khuấy đều để phản ứng xảy ra hoàn toàn, thu được 200 ml dung dịch X có pH = a và m gam kết tủa Y. Giá trị của a và m lần lượt là
A. 13 và 1,165. B. 2 và 2,330. C. 13 và 2,330. D. 7 và 1,165.
Câu 20: Trộn các dung dịch HCl 0,75M; HNO3 0,15M; H2SO4 0,3M với các thể tích bằng nhau thì được dung dịch X. Trộn 300 ml dung dịch X với 200 ml dung dịch Ba(OH)2 0,25M, thu được m gam kết tủa và dung dịch Y có pH = x. Giá trị của x và m lần lượt là:
A. 1 và 2,23 gam. B. 1 và 6,99 gam. C. 2 và 2,23 gam. D. 2 và 1,165 gam.
Câu 21: Trộn 200 ml dung dịch gồm HCl 0,1M và H2SO4 0,05M với 300 ml dung dịch Ba(OH)2 nồng độ xM, thu được m gam kết tủa và 500 ml dung dịch có pH = 13. Giá trị của x và m là
A. x = 0,015; m = 2,33. B. x = 0,150; m = 2,33. C. x = 0,200; m = 3,23. D. x = 0,020; m = 3,23.
Câu 22: Cho dung dịch X chứa hỗn hợp H2SO4 0,1M và HNO3 0,3M, dung dịch Y chứa hỗn hợp Ba(OH)2 0,2M và KOH 0,1M. Lấy a lít dung dịch X cho vào b lít dung dịch Y, thu được 1 lít dung dịch Z có pH = 13. Giá trị a, b lần lượt là
A. 0,5 lít và 0,5 lít. B. 0,6 lít và 0,4 lít.
C. 0,4 lít và 0,6 lít. D. 0,7 lít và 0,3 lít.
Câu 23: Dung dịch X gồm HCl 0,2M; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch Y gồm KOH 0,3M; NaOH 0,4M; Ba(OH)2 0,15M. Cần trộn X và Y theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH = 13?
A. 11: 9. B. 9 : 11. C. 101 : 99. D. 99 : 101.