Cho ngtử K(Z=19) a) viết cấu hình electron nguyên tử và biểu diễn cấu hình theo ô orbital của nguyên tử Cl b)hãy cho biết Cl là nguyên tố s,p hay d?giải thích

Những câu hỏi liên quan
Cho các nguyên tử: Al (Z = 13); S (Z = 16); O (Z =8); Fe (Z = 26); Cu (Z = 29); Zn (Z = 30); Cl (Z =
17); K (Z = 19); Br (Z = 35), Ne (Z = 10).
a. Viết cấu hình electron của các nguyên tử trên.
b. Cho biết nguyên tố nào thuộc nguyên tố s , p , d , f ? Vì sao?
c. Xác định kim loại, phi kim, khí hiếm?
Al : 1s22s22p63s23p1 ( kim loại vì lớp e ngoài cùng có 3e)
S : 1s22s22p63s23p4 ( phi kim vì lớp e ngoài cùng có 6e )
O : 1s22s22p4 ( phi kim vì lớp e ngoài cùng có 6e )
Fe : 1s22s22p63s23p63d64s2 ( kim loại vì lớp e ngoài cùng có 2e )
Cu : 1s22s22p63s23p63d104s1 ( kim loại vì lớp e ngoài cùng có 1e )
Zn : 1s22s22p63s23p63d104s2 ( kim loại vì lớp e ngoài cùng có 2e )
Cl : 1s22s22p63s23p5 ( kim loại vì lớp e ngoài cùng có 7e )
K : 1s22s22p63s23p64s1 ( kim loại vì lớp e ngoài cùng có 1e )
Br : 1s22s22p63s23p63d104s24p5 (kim loại vì lớp e ngoài cùng có 7e )
Ne : 1s22s22p6 ( khí hiếm vì lớp e ngoài cùng có 8e )
- Nguyên tố s : K ( e cuối cùng điền vào phân lớp s )
- Nguyên tố p : O, Ne, S, Cl, Br, Al ( e cuối cùng điền vào phân lớp p )
- Nguyên tố d : Fe, Cu, Zn ( e cuối cùng điền vào phân lớp d )
Đúng 1
Bình luận (0)
Hãy ghép cấu hình electron với nguyên tử thích hợp.
Cấu hình electron
Nguyên tử
A. 1s22s22p5
a) Cl
B. 1s22s22p4
b) S
C. 1s22s22p63s23p4
c) O
D. 1s22s22p63s23p5
d) F
Đọc tiếp
Hãy ghép cấu hình electron với nguyên tử thích hợp.
| Cấu hình electron | Nguyên tử |
| A. 1s22s22p5 | a) Cl |
| B. 1s22s22p4 | b) S |
| C. 1s22s22p63s23p4 | c) O |
| D. 1s22s22p63s23p5 | d) F |
A với d); B với c); C với b); D với a).
Đúng 0
Bình luận (0)
Nguyên tử X của 1 nguyên tố M có 19 hạt proton ,20 hạt nơtron .Hãy viết cấu hình electron ; xác định số khối ,viết kí hiệu nguyên tử ,và cho biết nguyên tố M là kim loại ,phi kim hay khí hiếm ? Giải thích ?
Nguyên tố X có tổng số hạt cơ bản là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10
a) Hãy viết kí hiệu nguyên tử của ngtố X
b) Việt cấu hình electron nguyên tử, cấu hình electron theo orbital của X
c) Từ cấu hình electron, dự đoán tính chất hoá học
d) Xác đinh vị trí của X trong bảng tuần hoàn
a, Ta có: P + N + E = 34
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 34 (1)
Theo đề, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=11=Z\\N=12\end{matrix}\right.\) ⇒ A = 11 + 12 = 23
→ KH: \(^{23}_{11}X\)
b, Cấu hình e: 1s22s22p63s1
Cấu hình e theo orbital:
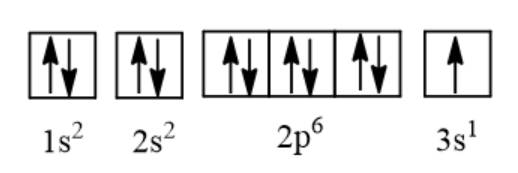
c, X có 1 e hóa trị → tính kim loại
d, - Z = 11 → ô số 11
- Có 3 lớp e → chu kỳ 3
- e cuối cùng phân bố ở phân lớp s, có 1 e hóa trị → nhóm IA
Vậy: X thuộc ô số 11, chu kỳ 3, nhóm IA
Đúng 0
Bình luận (0)
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc . nhóm VIIA : flo (F), clo (Cl), brom (Br), iot (I), atatin (At).
Hãy cho biết đặc điểm về cấu hình electron lớp ngoài cùng của các nguyên tử trên và từ đó cho biết đặc điểm về tính chất của các nguyên tố tương ứng.
F: 2 s 2 2 p 5 ; Cl: 3 s 2 3 p 5 ; Br: 4 s 2 4 p 5 ; I: 5 s 2 5 p 5 ; At: 6 s 2 6 p 5
Nguyên tử của các nguyên tố thuộc nhóm VIIA có 7 electron ở lớp ngoài cùng với cấu hình ns 2 np 5
Vì chỉ kém khí hiếm đứng sau 1 electron nên trong các phản ứng hoá học, các nguyên tử có khuynh hướng thu thêm 1 electron để đạt được cấu hình vững bền của các khí hiếm đứng sau. Do đó, trong các hợp chất với nguyên tố kim loại, các nguyên tố thuộc nhóm VIIA có hoá trị 1.
Đúng 0
Bình luận (0)
Cho Mg(Z=12),O(Z=8) a, Viết cấu hình e nguyên tử của nguyên tốAl,S b,Hãy cho biết Mg,O là kim loại- phi kim-khí hiếm.Nguyên tố s,p hay d?Giải thích.
\(a.CHecủaAl:1s^22s^22p^63s^23p^1\\ CHecủaS:1s^22s^22p^63s^23p^4\)
b.\(CHecủaMg:1s^22s^22p^63s^2\\ CHecủaO:1s^22s^22p^4\)
Do Mg có cấu hình e lớp ngoài cùng là 3s2
=> Có 2e lớp ngoài cùng (Kim loại), là nguyên tố s
Do O có cấu hình e lớp ngoài cùng là 2s22p4
=> Có 6e lớp ngoài cùng (Phi kim), là nguyên tố p
Đúng 1
Bình luận (0)
Hãy viết cấu hình electron nguyên tử của agon (Ar) và cấu hình electron của các anion : S 2 - , Cl -
Hãy so sánh cấu hình electron của các anion đó với cấu hình electron nguyên tử của Ar và cho nhận xét.
Ar: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
S 2 - : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Cl - : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Nhận xét : Các anion S 2 - , Cl - có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm Ar đứng sau.
Đúng 0
Bình luận (0)
nguyên tố y có phân lớp cuối cùng thuộc phân mức năng lượng cao nhất 3d3
a) viết cấu hình electron nguyên tử y và cho biết y thuộc nguyên tố s,p,d hay f
b) y là kim loại phi kim hay khí hiếm giải thích
c) viết cấu hình electron nguyên tử của ion được hình thành từ y
Biểu diễn cấu hình theo ô orbital (chỉ với lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử.
Số hiệu nguyên tử Z | Orbital | Số electron độc thân |
1 | 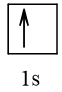 | 1 |
2 | 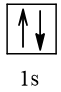 | 0 |
3 | 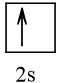 | 1 |
4 | 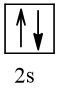 | 0 |
5 | 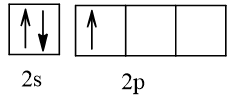 | 1 |
6 | 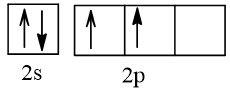 | 2 |
7 | 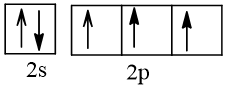 | 3 |
8 | 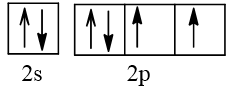 | 2 |
9 | 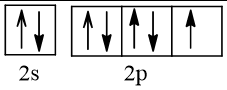 | 1 |
10 | 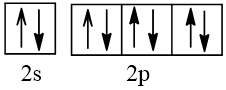 | 0 |
11 | 1 | |
12 | 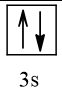 | 0 |
13 | 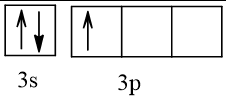 | 1 |
14 | 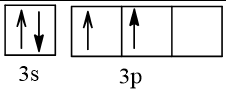 | 2 |
15 | 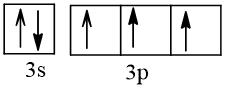 | 3 |
16 | 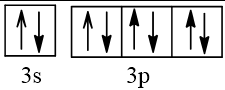 | 2 |
17 | 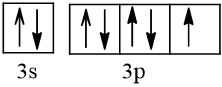 | 1 |
18 | 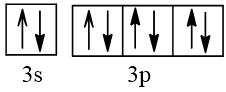 | 0 |
19 | 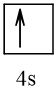 | 1 |
20 | 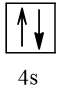 | 0 |
Đúng 0
Bình luận (0)