Tìm x€N
a) 100<5^2n-2<5^6
b) 141<6^n<50
c) 25<4^n<100
d) 5^3n<300
e) 5^n<90
Bài 1) Tìm x
A) x ⋮ 10, x ⋮ 15 và x < 100.
B) 24 ⋮ x, 36 ⋮ x, x lớn nhất
C) x ⋮ 4, x ⋮ 7, x ⋮ 8, x nhỏ nhất
Bài 2) Tìm x ∈ N
A) 6 ⋮ (x - 1)
B) 15 ⋮ (x + 3)
C) 12 ⋮ (x + 3)
D) (x + 16) ⋮ (x + 1)
Cần gấp ạ
Bài 2:
a: \(\Leftrightarrow x-1\in\left\{1;-1;2;-2;3;-3;6;-6\right\}\)
=>\(x\in\left\{2;0;3;-1;4;-2;7;-5\right\}\)
b: \(\Leftrightarrow x+3\in\left\{1;-1;3;-3;5;-5;15;-15\right\}\)
=>\(x\in\left\{-2;-4;0;-6;2;-8;12;-18\right\}\)
c: \(\Leftrightarrow x+3\in\left\{1;-1;2;-2;3;-3;4;-4;6;-6;12;-12\right\}\)
=>\(x\in\left\{-2;-4;-1;-5;0;-6;1;-7;3;-9;9;-15\right\}\)
d: =>x+1+15 chia hết cho x+1
=>\(x+1\in\left\{1;-1;3;-3;5;-5;15;-15\right\}\)
=>\(x\in\left\{0;-2;2;-4;4;-6;14;-16\right\}\)
Chất hữu cơ X có công thức phân tử C7H8O2. Tìm công thức cấu tạo của X biết: X tác dụng với Na giải phóng hiđro, với n H 2 : n x = 1 : 1 ; trung hoà 0,2 mol X cần dùng đúng 100 ml dung dịch NaOH 2M.
A. HOC6H4CH2OH
B. C6H3(OH)2CH3
C. HOCH2OC6H5
D. CH3OC6H4OH
Chất hữu cơ X có công thức phân tử C 7 H 8 O 2 . Tìm công thức cấu tạo của X biết: X tác dụng với Na giải phóng hiđro, với n H 2 : n X = 1 : 1 ; trung hoà 0,2 mol X cần dùng đúng 100 ml dung dịch NaOH 2M.
A. C 6 H 3 ( O H ) 2 C H 3
B. H O C H 2 O C 6 H 5
C. H O C 6 H 4 C H 2 O H
D. C H 3 O C 6 H 4 O H
X là dung dịch Al ( NO 3 ) 3 aM. Thêm 6,21 gam Na vào 100 ml dung dịch X (TN1) thu được m gam kết tủa. Mặt khác, nếu thêm 6,44 gam Na vào 100 ml dung dịch X (TN2) thì thu được 0,8m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của a là
A. 1,2M
B. 0,9M
C. 0,8M
D. 1,24M
Đáp án C
Ta có:
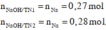
Theo giả thiết, suy ra : Ở TN2 kết tủa đã bị hòa tan một phần; ở TN1 kết tủa có thể đã bị hòa tan hoặc chưa.
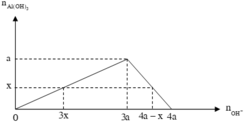
● Nếu ở TN1 kết tủa chưa bị hòa tan thì căn cứ vào dạng hình học của đồ thị, ta có:
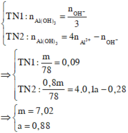
Suy ra : TN 1 : n Al ( OH ) 3 = 0 , 088 < n OH - 3 = 0 , 09 ( loại ) Vì như thế có nghĩa là đã có hiện tượng hòa tan kết tủa.
● Nếu ở TN1 kết tủa đã bị hòa tan thì căn cứ vào dạng hình học của đồ thị, ta có:

Trong 100 ml dung dịch X có 0,003 mol Na+; 0,001 mol SO42− và x mol OH−. Tính pH của dung dịch X?
Bảo toàn điện tích :
$n_{OH^-} = 0,003 - 0,001.2 = 0,001(mol)$
$[OH^-] = \dfrac{0,001}{0,1} = 0,01M$
$pOH = -log(0,01) = 2$
$\Rightarrow pH = 14 - pOH = 14 - 2 = 12$
Bài 1:Tìm STN x biết
a) 35 chia hết cho x cộng3
b) 10 chia hết cho(2x cộng 1)
c) x cộng 7 chia hết cho 25 và x < 100
D) (x cộng 13) chia hết cho ( x cộng 1)
e) 2 . x cộng 108 chia hết cho 2. x cộng 3
Giúp mk na mọi người!!!!!!!!
28.Hoà tan hoàn toàn 6,2g hai kim loại kiềm ở 2 chu kì liên tiếp vào nước thu được H2 (đktc) và dung dịch X. Trung hòa ½ dung dịch X cần 100 ml dung dịch HCl 1M. Hai kim loại là
A. Li và Na B. Na và K C. K và Rb D. Rb và Cs
.29Cho 3,04g hỗn hợp hai hidroxit của hai kim loại kiềm ở 2 chu kì liên tiếp tác dụng với axit HCl thu được 4,15g hỗn hợp muối clorua. Khối lượng của mỗi hiđroxit trong hỗn hợp lần lượt là
A. 1,17g và 2,98g B. 1,12g và 1,6g C. 1,12g và 1,92g D. 0,8g và 2,24g
Bài 30. Cho 2 gam một kim loại thuộc nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua . Kim loại đó là kim loại nào sau đây ?
A. Be B. Mg C. Ca D. Ba
Bài 31. Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là
A. Be và Mg. B. Mg và Ca. C. Sr và Ba. D. Ca và Sr.
Bài 32. Cho 18,4g hỗn hợp 2 muối cacbonat của kim loại thuộc nhóm IIA ở 2 chu kì liên tiếp tác dụng hết với dung dịch HCl. Cô cạn dung dịch sau khi phản ứng thu được 20,6g muối khan. Hai kim loại đó là
A. Be và Mg B. Mg và Ca C. Ca và Sr D. Sr và Ba
Bài 33: Cho 6,2 gam hỗn hợp hai kim loại kiềm tác dụng hết với nước thấy có 2,24 lít H2( đktc ) bay ra. Cô cạn dung dịch thì khối lượng chất rắn khan thu được là :
A. 9,4 gam B. 9,5 gam C. 9,6 gam D. 9,7 gam
Bài 31:
Gọi CT chung của 2 kim loại nhóm IIA (kim loại X,Y) cần tìm là Z. (M(X)<M(Z)<M(Y))
Ta có: Z +2 HCl -> ZnCl2 + H2
nH2=0,672/22,4=0,03=nZ
=> 24<M(Z)=mZ/nZ= 1,67/0,03=35,667<40
=> M(Mg) < M(Z) < M(Ca)
=> X là Magie (Mg), Y là Canxi (Ca)
=> CHỌN B
Bài 33:
nH2=0,1(mol) => mH2=0,1.2=0,2(g)
Đặt CTHH chung của 2 kim loại kiềm là A.
PTHH: A + H2O -> AOH + 1/2 H2
nH2O=nH2.2=0,1.2=0,2(mol) => mH2O=3,6(g)
Theo ĐLBTKL ta có:
mA+ mH2O = mAOH + mH2
<=>mAOH=(mA+mH2O) - mH2= 6,2 + 3,6 - 0,2= 9,6(g)
=> m(rắn)=9,6(g)
=> CHỌN C
Bài 32: Gọi CTTQ của hợp chất muối cacbonat của 2 kim loại nhóm IIA là ACO3. (A là CT chung của kim loại)
PTHH: ACO3 + 2 HCl -> ACl2 + CO2 + H2O
Ta có:
\(n_A=\dfrac{20,6-18,4}{\left(M\left(A\right)+71\right)-\left(M\left(A\right)-60\right)}=0,2\left(mol\right)\\ M_{ACO3}=\dfrac{18,4}{0,2}=92\left(\dfrac{g}{mol}\right)=M_A+60\\ \Leftrightarrow M_A=32\left(\dfrac{g}{mol}\right)\)
Vì A là 2 kim loại nhóm IIA liên tiếp (gọi là X,Y): M(X)<M(A)<M(Y)
=> X,Y là Magie (Mg) và Canxi (Ca)
=> CHỌN B
Hoà tan hoàn toàn 6,2g hai kim loại kiềm ở 2 chu kì liên tiếp vào nước thu được H2 (đktc) và dung dịch X. Trung hòa ½ dung dịch X cần 100 ml dung dịch HCl 1M. Hai kim loại là
A. Li và Na B. Na và K C. K và Rb D. Rb và Cs
Hoà tan hoàn toàn 6,2g hai kim loại kiềm ở 2 chu kì liên tiếp vào nước thu được H2 (đktc) và dung dịch X. Trung hòa ½ dung dịch X cần 100 ml dung dịch HCl 1M. Hai kim loại là
A. Li và Na B. Na và K C. K và Rb D. Rb và Cs
Gọi 2 kim loại cần tìm là R
\(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\)
\(ROH+HCl\rightarrow RCl+H_2O\)
Số mol của 1/2 dung dịch X : \(n_{ROH}=n_{HCl}=0,1\left(mol\right)\)
\(n_{R\left(bđ\right)}=n_{ROH}=0,2\left(mol\right)\)
=> \(M_R=\dfrac{6,2}{0,2}=31\)
Vì hai kim loại kiềm ở 2 chu kì liên tiếp
=> 2 kim loại cần tìm là Na và K
=> Chọn B
giải hộ na!!!!!!!!!!!!!!!!!!!!!
tìm x biết
x + 3^2 . 3 = 7^5 : 7^3
ĐÚNG + NHANH = TICK NA
\(x+\)\(3^2\times3=7^2\)
\(x+3^3=7^2\)
\(x=49-27\)
\(x=22\)
(x-1)/(x+5) = 6/7
tìm x na
(x-1)/(x+5)=6/7
7(x-1)=6(x+5)
7x-7=6x+30
7x-6x=7+30
x=37