d) Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945
kJ/mol và 607 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng dưới đây bằng bao nhiêu?
N2(g) + O2(g) 2NO(g)
A. -832 kJ. B. +832 kJ. C. -225 kJ. D. +225 kJ.

Những câu hỏi liên quan
a) Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng:
N2(g) + O2(g) → 2NO(g)
b) Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
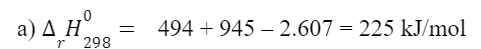
b) Trong N2, liên kết giữa 2 nguyên tử là liên kết ba – một loại liên kết bển, cần 1 năng lượng rất lớn để phá vỡ liên kết đó.
=> N2 khá trơ về mặt hóa học và chỉ phản ứng với oxy khi có nhiệt đô cao hoặc có tia lửa điện
Đúng 1
Bình luận (0)
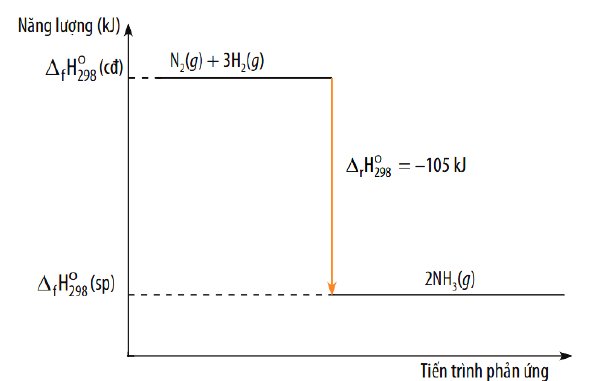
c) Tính biến thiên enthanpy của phản ứng tạo thành ammonia (sử dụng năng lượng liên kết).
Cho biết phản ứng thu nhiệt hay toả nhiệt và vẽ sơ đồ biểu diễn biến thiên enthalpy của phản
ứng 3H2 (g) + N2 (g) → 2NH3 (g)
Liên kết Eb (kJ/ mol)
H – N 386
H – H 436
N ≡ N 945
\(\Delta_rH^{^{ }o}_{298}=3\cdot436+945-2\left(3\cdot386\right)=-63kJ\cdot mol^{-1}\)
Sơ đồ:
Đúng 1
Bình luận (0)
a) Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
4FeS2 (s) + 11O2 (g) → 2Fe2O3 (s) + 8SO2 (g)
Biết nhiệt tạo thành ΔrH0298 của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là -177,9 kJ/mol,
-825,5 kJ/mol và -296,8 kJ/mol.
\(\Delta_rH^o_{298}=2\left(-825,5\right)+8\left(-296,8\right)-4\left(-177,9\right)\\ \Delta_rH^o_{298}=-3313,8\left(kJ\right)\)
Đúng 2
Bình luận (0)
Enthalpy tạo thành của H2O2 là -133 kJ mol-1, năng lượng liên kết OH là 463 kJ mol-1 và năng lượng phân ly H2, O2 lần lượt là 436 và 495 kJ mol-1. Tính năng lượng liên kết OO trong H2O2
Đọc tiếp
Enthalpy tạo thành của H2O2 là -133 kJ mol-1, năng lượng liên kết O![]() H là 463 kJ mol-1 và năng lượng phân ly H2, O2 lần lượt là 436 và 495 kJ mol-1. Tính năng lượng liên kết O
H là 463 kJ mol-1 và năng lượng phân ly H2, O2 lần lượt là 436 và 495 kJ mol-1. Tính năng lượng liên kết O![]() O trong H2O2
O trong H2O2
\(H_2+O_2->H_2O_2\\ \Delta_fH=E_{H-H}+E_{O=O}-2E_{H-O}-E_{O-O}\\ -133=436+495-2\cdot463-E_{O-O}\\ E_{O-O}=138kJ\cdot mol^{-1}\)
Đúng 1
Bình luận (0)
d) Xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol ethane. Biết nhiệt tạo thành
chuẩn của C2H6 (l), CO2 (g) và H2O (l) tương ứng là -84,7 kJ/mol, -393,5 kJ/mol và -285,8
kJ/mol.
\(C_2H_6+\dfrac{7}{2}O_2->2CO_2+3H_2O\\ \Delta_rH^o_{298}=2\left(-393,5\right)+3\left(-285,8\right)-\left(-84,7\right)\\ \Delta_rH^o_{298}=-1559,7kJ\)
Đúng 1
Bình luận (2)
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:4NH3(g) + 5O2(g) (Pt, t°) → 4NO(g) + 6H2O(g)a) Tính ΔrH^0_{298} của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 90,3 kJ/mol và -241,8 kJ/mol.b) Tính năng lượng liên kết trong phân tử NO. Biết năng lượng liên kết N─H, O═O, O─H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.
Đọc tiếp
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
4NH3(g) + 5O2(g) (Pt, t°) → 4NO(g) + 6H2O(g)
a) Tính Δ\(rH^0_{298}\) của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?
Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 90,3 kJ/mol và -241,8 kJ/mol.
b) Tính năng lượng liên kết trong phân tử NO. Biết năng lượng liên kết N─H, O═O, O─H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.
a) Tính biến thiên enthalpy chuẩn của phản ứng: H2 (g) + Cl2 (g) → 2HCl (g)
Biết Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/mol
\(\Delta_rH^o_{298}=436+243-2\cdot432\\ \Delta_rH^o_{298}=-185kJ\cdot mol^{-1}\)
Đúng 1
Bình luận (0)
Để tính biến thiên enthalpy chuẩn của phản ứng, ta có thể sử dụng công thức sau:
ΔH° = (tổng năng lượng liên kết sản phẩm) - (tổng năng lượng liên kết phản ứng chất). Trong trường hợp này, ta có: Tổng năng lượng liên kết phản ứng chất = Eb(H-H) + Eb(Cl-Cl) = 436 + 243 = 679 kJ/mol Tổng năng lượng liên kết sản phẩm = 2Eb(H-Cl) = 2 * 432 = 864 kJ/mol Vậy biến thiên enthalpy chuẩn của phản ứng là: ΔH° = 864 - 679 = 185 kJ/mol.
Đúng 0
Bình luận (0)
b) Xác định biến thiên enthalpy chuẩn của phản ứng.
C2H4(g) + H2(g) → C2H6(g)
biết Eb (H—H) = 436 kJ/mol, Eb (C—H) = 418 kJ/mol, Eb (C—C) = 346 kJ/mol, Eb (C=C) = 612 kJ/mol
\(\Delta_rH^o_{298}=\left(612+4\cdot418\right)+436-\left(346+6\cdot418\right)\\ \Delta_rH^o_{298}=-134kJ\cdot mol^{-1}\)
Đúng 1
Bình luận (0)
Để xác định biến thiên enthalpy chuẩn của phản ứng, ta có thể sử dụng công thức sau: ΔH° = (tổng năng lượng liên kết sản phẩm) - (tổng năng lượng liên kết phản ứng chất). Trong trường hợp này, ta có: Tổng năng lượng liên kết phản
ứng chất = Eb(C=C) + Eb(H-H) = 612 + 436 = 1048 kJ/mol Tổng năng lượng liên kết sản phẩm = 6Eb(C-H) + Eb(C-C) = 6 * 418 + 346 = 2950 kJ/mol Vậy biến thiên enthalpy chuẩn của phản ứng là: ΔH° = 2950 - 1048 = 1902 kJ/mol.
Đúng 0
Bình luận (1)
Biết năng lượng liên kết của phân tửCl2là 243 kJ mol-1, năng lượng ion hoá thứ nhất của nguyên tử Cl và phân tử Cl2 lần lượt là 1 250 và 1 085 kJ mol-1. Tính năng lượng liên kết của Cl2 + và thảo luận tiểu phân nào (Cl2, Cl2 +) có liên kết dài hơn. Giải thích.
Đọc tiếp
Biết năng lượng liên kết của phân tửCl2là 243 kJ mol-1, năng lượng ion hoá thứ nhất của nguyên tử Cl và phân tử Cl2 lần lượt là 1 250 và 1 085 kJ mol-1. Tính năng lượng liên kết của Cl2 + và thảo luận tiểu phân nào (Cl2, Cl2 +) có liên kết dài hơn. Giải thích.
Ta có hai sơ đồ ứng với quá trình:
\(Cl_2->2Cl->Cl^+,Cl\\ Cl_2->Cl_2^+->Cl^+,Cl\)
Theo nguyên lý I của nhiệt động học:
\(E_{b\left(Cl_2\right)}+IE_{Cl}=IE_{Cl_2}+E_{b\left(Cl_2^+\right)}\\ E_{b\left(Cl_2^+\right)}=243+1250-1085=408kJ\cdot mol^{-1}\\ E_{b\left(Cl_2^+\right)}>E_{b\left(Cl_2\right)}\)
Vì \(Cl_2^+\) có ít hơn một e phản liên kết so với Cl2, bậc liên kết cao hơn (1.5), do đó tiểu phân \(Cl_2\) có liên kết dài hơn.
Đúng 1
Bình luận (0)












