Viết phương trình điện li (nếu có) của các chất sau khi hoà tan vào nước: HNO3, Ca(OH)2 và BaCl2.

Những câu hỏi liên quan
Trong nước biển, magie là kim loại có hàm lượng lớn thứ hai sau natri. Mỗi kilogam nước biển chứa khoảng 1,3 g magie dưới dạng các ion
M
g
2
+
. Ở nhiều quốc gia, magie được khai thác từ nước biển. Quá trình sản xuất magie từ nước biển gồm các giai đoạn sau :1. Nung đá vôi thành vôi sống.2. Hoà tan vôi sống trong nước biển tạo ra kết tủa
M
g
(
O...
Đọc tiếp
Trong nước biển, magie là kim loại có hàm lượng lớn thứ hai sau natri. Mỗi kilogam nước biển chứa khoảng 1,3 g magie dưới dạng các ion M g 2 + . Ở nhiều quốc gia, magie được khai thác từ nước biển. Quá trình sản xuất magie từ nước biển gồm các giai đoạn sau :
1. Nung đá vôi thành vôi sống.
2. Hoà tan vôi sống trong nước biển tạo ra kết tủa M g ( O H ) 2 .
3. Hoà tan kết tủa M g ( O H ) 2 trong dung dịch HCl.
4. Điện phân M g C l 2 nóng chảy:
![]()
Viết các phương trình hoá học dưới dạng phân tử và ion rút gọn (nếu có) của quá trình sản xuất trên.
Viết phương trình điện li của các chất sau: H2CO3, H2S, Al(OH)3, NaHS, Ca(HCO3)2, KH2PO4, (NH4)2SO4, KHSO4
\(H_2CO_3⇌H^++HCO_3^-\)
\(HCO_3^-⇌H^++CO_3^{2-}\)
Đúng 1
Bình luận (0)
\(Al\left(OH\right)_3⇌Al^{3+}+3OH^-\)
Hoặc \(Al\left(OH\right)_3⇌AlO_2^-+H^++H_2O\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Sục 8,96 lít CO2 (đktc) vào 500 ml dung dịch hỗn hợp NaOH 0,5M và Ba(OH)2 0,25M, phần nước lọc sau khi phản ứng xảy ra hoàn toàn lần lượt cho tác dụng với các dung dịch HNO3; BaCl2; Na2CO3; Ca(OH)2; NaHSO4; NaOH. Số chất có xảy ra phản ứng là: A. 4 B. 5 C. 3 D. 6
Đọc tiếp
Sục 8,96 lít CO2 (đktc) vào 500 ml dung dịch hỗn hợp NaOH 0,5M và Ba(OH)2 0,25M, phần nước lọc sau khi phản ứng xảy ra hoàn toàn lần lượt cho tác dụng với các dung dịch HNO3; BaCl2; Na2CO3; Ca(OH)2; NaHSO4; NaOH. Số chất có xảy ra phản ứng là:
A. 4
B. 5
C. 3
D. 6
n CO2 = 0,4 mol ; n OH- = 0,5 mol
=> n CO32- = 0,1 mol ; n HCO3- = 0,3 mol . Có n Ba2+ = 0,125 mol
=> Ba2+ + CO32- → BaCO3 => CO32- Hết
Dd sau gồm Na+ ; Ba2+ ; HCO3-
=> phản ứng với HNO3 ; Na2CO3 ; Ca(OH)2 ; NaHSO4 ; NaOH
=> Có 5 chất
=>B
Đúng 0
Bình luận (0)
Viết phương trình điện li của axit yếu
C
H
3
C
O
O
H
trong dung dịch. Nếu hoà tan ít tinh thể chất điện li mạnh
C
H
3
C
O
O
N
a
vào dung dịch axit trên thì nồng độ
H
+
tăng hay giảm ? Giải thích dựa vào nguyên lí chuyển dịch cân bằng Lơ Satơliê.
Đọc tiếp
Viết phương trình điện li của axit yếu C H 3 C O O H trong dung dịch. Nếu hoà tan ít tinh thể chất điện li mạnh C H 3 C O O N a vào dung dịch axit trên thì nồng độ H + tăng hay giảm ? Giải thích dựa vào nguyên lí chuyển dịch cân bằng Lơ Satơliê.
C H 3 C O O H ↔ C H 3 C O O - + H + ( 1 )
C H 3 C O O N a phân li trong dung dịch như sau :
C H 3 C O O N a → C H 3 C O O - + N a +
Sự phân li của C H 3 C O O H là quá trình thuận nghịch. Đây là cân bằng động. Khi hoà tan C H 3 C O O N a vào thì nồng độ C H 3 C O O - tăng lên, làm cho cân bằng (1) chuyển dịch từ phải sang trái, nên nồng độ H + giảm xuống.
Đúng 0
Bình luận (0)
Câu 2: Hoàn thành các phương trình phản ứng sau (nếu có):
H2SO4 + KOH → Ba(OH)2 + HCl →
Fe(OH)2 + HCl → Al(OH)3 + H2SO4 →
HCl + Na2CO3 → HNO3 + Ca(HCO3)2 →
NaOH + CuSO4 → Ca(OH)2 + BaCl2 →
Fe2(SO4)3 + KOH → FeSO4 + Cu(OH)2 →
CaCl2 + AgNO3 → Ba(OH)2 + K2SO4 →
Ba(OH)2 + Fe2(SO4)3 → Na2CO3 + BaCl2 →
Ba(HCO3)2 + Na2CO3 → MgCO3 + K2SO4 →
Ca(HCO3)2 + KOH → NaHSO4 + KOH →
2AgNO3 + CaCl2 → 2AgCl + Ca(NO3)2
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Fe(OH)3
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
Ba(HCO3)2 + Na2CO3 → BaCO3 + 2NaHCO3
MgCO3 + K2SO4 ----//---->
Ca(HCO3)2 + 2KOH → CaCO3 + K2CO3 + 2H2O
2NaHSO4 + 2KOH → K2SO4 + Na2SO4 + 2H2O
Đúng 3
Bình luận (0)
2KOH + H2SO4 → K2SO4 + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Ca(HCO3)2 + 2HNO3 → Ca(NO3)2 + 2H2O + 2CO2
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Ca(OH)2 + BaCl2 ----//---->
Fe2(SO4)3 + 6KOH → 3K2SO4 + 2Fe(OH)3
FeSO4 + Cu(OH)2 ----//---->
Đúng 3
Bình luận (0)
Phân loại chất điện li và viết phương trình điện li của các chất sau: K2S, NaH2PO4, Pb(OH)2, CaO, HCOOH, MgCl2, Al2(SO4)3, H2CO3, H3PO4, Ba(OH)2
Câu2: Viết phương trình điện li của những chất sau: a) Các chất điện li mạnh: Ba(NO3)2, HNO3, KOH. b) chất điện li yếu: HCLO, HNO2, H2CO3
a, \(Ba\left(NO_3\right)_2\rightarrow Ba^{2+}+2NO_3^-\)
\(HNO_3\rightarrow H^++NO_3^-\)
\(KOH\rightarrow K^++OH^-\)
b, \(HClO⇌H^++ClO^-\)
\(HNO_2⇌H^++NO_2^-\)
\(H_2CO_3⇌2H^++CO_3^{2-}\)
Đúng 1
Bình luận (0)
Chọn câu đúngChỉ có hợp chất ion mới bị điện li khi hoà tan trong nước.Độ điện li chỉ phụ thuộc vào bản chất chất điện li.Với chất điện li yếu, độ điện li bị giảm khi nồng độ tăng.Độ điện li của chất điện li yếu có thể bằng 1Câu 6:Trong các chất sau: K3PO4, H2SO4, HClO, HNO2, NH4Cl, HgCl2, Sn(OH)2. Các chất điện li yếu làHClO, HNO2, HgCl2, Sn(OH)2.HClO, HNO2, K3PO4, H2SO4.HgCl2, Sn(OH)2, NH4Cl, HNO2.HgCl2, Sn(OH)2, HNO2, H2SO4.:Chọn dãy các chất điện ly mạnh trong số các chất sau : a. NaCl. b. B...
Đọc tiếp
Chọn câu đúng
Chỉ có hợp chất ion mới bị điện li khi hoà tan trong nước.
Độ điện li chỉ phụ thuộc vào bản chất chất điện li.
Với chất điện li yếu, độ điện li bị giảm khi nồng độ tăng.
Độ điện li của chất điện li yếu có thể bằng 1
Câu 6:Trong các chất sau: K3PO4, H2SO4, HClO, HNO2, NH4Cl, HgCl2, Sn(OH)2. Các chất điện li yếu là
HClO, HNO2, HgCl2, Sn(OH)2.
HClO, HNO2, K3PO4, H2SO4.
HgCl2, Sn(OH)2, NH4Cl, HNO2.
HgCl2, Sn(OH)2, HNO2, H2SO4.
:Chọn dãy các chất điện ly mạnh trong số các chất sau : a. NaCl. b. Ba(OH)2. c. HNO3. d. HgCl2. e. Cu(OH)2. f. MgSO4
a, b, c, f.
a, d, e, f.
b, c, d, e.
a, b, c, e.
Câu 10:Trong dung dịch axit axetic (CH3COOH) có những phần tử nào sau đây:
H+, CH3COO- .
CH3COOH, H+, CH3COO-, H2O.
H+, CH3COO-, H2O.
CH3COOH, CH3COO-, H+
Câu 11:Dung dịch A chứa 0,23 gam ion Na +; 0,12 gam ion Mg 2+; 0,355 gam ion Cl - và m gam ionSO42–. Số gam muối khan sẽ thu đ ược khi cô cạn dung dịch A l à
1,185 gam.
1,19 gam.
1,2 gam.
1,158 gam.
Câu 12:Câu nào dưới đây là đúng khi nói về sự điện li
Sự điện li là sự hòa tan một chất vào nước tạo ra dd .
Sự điện li thực chất là quá trình oxi hóa khử.
Sự điện li là sự phân li 1 chất thành ion dương và ion âm khi chất đó tan trong nước.
Sự điện li là sự phân li 1 chất dưới tác dụng của dòng điện
Câu 13:Một dung dịch A chứa HCl và H2SO4 theo tỉ lệ mol 3:1. 100ml dung dịch A trung hòa vừa đủ bởi 50ml dung dịch NaOH 0,5M. Nồng độ mol mỗi axit là?.
Chọn câu đúng
Chỉ có hợp chất ion mới bị điện li khi hoà tan trong nước.
Độ điện li chỉ phụ thuộc vào bản chất chất điện li.
Với chất điện li yếu, độ điện li bị giảm khi nồng độ tăng.
Độ điện li của chất điện li yếu có thể bằng 1
Câu 6:Trong các chất sau: K3PO4, H2SO4, HClO, HNO2, NH4Cl, HgCl2, Sn(OH)2. Các chất điện li yếu là
HClO, HNO2, HgCl2, Sn(OH)2.
HClO, HNO2, K3PO4, H2SO4.
HgCl2, Sn(OH)2, NH4Cl, HNO2.
HgCl2, Sn(OH)2, HNO2, H2SO4.
:Chọn dãy các chất điện ly mạnh trong số các chất sau : a. NaCl. b. Ba(OH)2. c. HNO3. d. HgCl2. e. Cu(OH)2. f. MgSO4
a, b, c, f.
a, d, e, f.
b, c, d, e.
a, b, c, e.
Câu 10:Trong dung dịch axit axetic (CH3COOH) có những phần tử nào sau đây:
H+, CH3COO- .
CH3COOH, H+, CH3COO-, H2O.
H+, CH3COO-, H2O.
CH3COOH, CH3COO-, H+
Câu 11:Dung dịch A chứa 0,23 gam ion Na +; 0,12 gam ion Mg 2+; 0,355 gam ion Cl - và m gam ionSO42–. Số gam muối khan sẽ thu đ ược khi cô cạn dung dịch A l à
1,185 gam.
1,19 gam.
1,2 gam.
1,158 gam.
\( n_{Na^+} + 2n_{Mg^{2+}} = n_{Cl^-} + 2n_{SO_4^{2-}} \Rightarrow n_{SO_4^{2-}}=0,005 \)
\(\Rightarrow m=0,23+0,12+0,355+0,005.96=1,185 \)(g)
Câu 12:Câu nào dưới đây là đúng khi nói về sự điện li
Sự điện li là sự hòa tan một chất vào nước tạo ra dd .
Sự điện li thực chất là quá trình oxi hóa khử.
Sự điện li là sự phân li 1 chất thành ion dương và ion âm khi chất đó tan trong nước.
Sự điện li là sự phân li 1 chất dưới tác dụng của dòng điện
Câu 13:Một dung dịch A chứa HCl và H2SO4 theo tỉ lệ mol 3:1. 100ml dung dịch A trung hòa vừa đủ bởi 50ml dung dịch NaOH 0,5M. Nồng độ mol mỗi axit là?.
Phương trình phản ứng trung hoà
H++ OH------> H2O (1)
Gọi số mol H2SO4 trong 100 ml ddA là x => số mol HCl là 3x
nH+ = 2x + 3x = 5x (mol)
nOH- = 0,5.0,05 = 0,025 (mol)
Theo PT: nH+ = nOH-
=> 5x = 0,025
=> x = 0,005
\(CM_{HCl}=\dfrac{3.0,005}{0,01}=0,15M\)
\(CM_{H_2SO_4}=\dfrac{0,005}{0,01}=0,05M\)
Đúng 0
Bình luận (0)
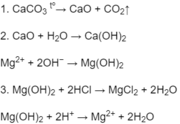
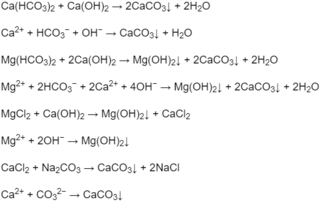
Nước chứa nhiểu ion
C
a
2
+
và
M
g
2
+
là nước cứng. Nước chứa ít hoặc không chứa các ion
C
a
2
+
và
M
g
2
+
là nước mềm.Để loại các ion
C...
Đọc tiếp
Nước chứa nhiểu ion C a 2 + và M g 2 + là nước cứng. Nước chứa ít hoặc không chứa các ion C a 2 + và M g 2 + là nước mềm.Để loại các ion C a 2 + và M g 2 + dưới dạng Ca ( H C O 3 ) 2 , Mg ( H C O 3 ) 2 và Mg C l 2 (người ta cho sữa vôi C a ( O H ) 2 vào nước sẽ tạo ra các kết tủa C a C O 3 va M g ( O H ) 2 . Để loại C a 2 + dưới dạng Ca C l 2 người ta hoà tan N a 2 C O 3 vào nước sẽ tạo kết tủa C a C O 3 .Hãy viết các phương trình hoá học dưới dạng phân tử và ion rút gọn của các phản ứng trên.