Trong các cân bằng (7), (8a) và (8b), xác định các acid và các base.

Những câu hỏi liên quan
So sánh được tính acid và base của các oxide và hydroxide dựa vào vị trí nguyên tố tạo nên chúng trong bảng tuần hoàn nguyên tố hóa học.
Để so sánh được tính acid và base của các oxide và hydroxide dựa vào vị trí nguyên tố tạo nên chúng trong bảng tuần hoàn nguyên tố hóa học cần ghi nhớ:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Đúng 0
Bình luận (0)
Đo và xác định khối lượngChuẩn bị: cân điện tử.Tiến hành: đo khối lượng cuốn sách Khoa học tự nhiên 7 bằng cân điện tử.Thảo luận nhóm, hoàn thành bảng mẫu và thực hiện yêu cầu sau:Hãy xác định khối lượng của cuốn sách và nhận xét kết quả của các lần đo so với kết quả trung bình.
Đọc tiếp
Đo và xác định khối lượng
Chuẩn bị: cân điện tử.
Tiến hành: đo khối lượng cuốn sách Khoa học tự nhiên 7 bằng cân điện tử.
Thảo luận nhóm, hoàn thành bảng mẫu và thực hiện yêu cầu sau:
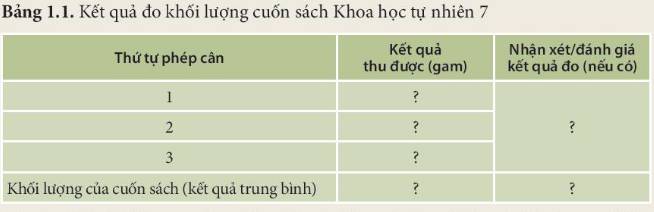
Hãy xác định khối lượng của cuốn sách và nhận xét kết quả của các lần đo so với kết quả trung bình.
Học sinh tự thực hiện thí nghiệm
Hướng dẫn cách đo:
- Khối lượng cuốn Khoa học tự nhiên 7 khoảng từ 1 – 2 kg: sử dụng cân điện tử
- Đặt cuốn sách lên cân điện tử và nhìn kết quả trên cân
- Thực hiện phép đo 3 lần và ghi kết quả vào bảng
=> Nhận xét: Khối lượng của cuốn sách (kết quả trung bình) gần bằng kết quả thu được sau mỗi lần đo.
Đúng 0
Bình luận (0)
Trong một buổi họp mặt giữa hai lớp 8A và 8B, có tất cả 50 học sinh tham gia. Các bạn lớp 8B tính số người quen ở lớp 8A và thấy rằng bạn Anh quen 11 bạn, bạn Bắc quen 12 bạn, bạn Châu quen 13 bạn,…và cứ như vậy đến bạn cuối cùng là bạn Yến quen tất cả các bạn của lớp 8A. Tính số học sinh mỗi lớp tham gia họp mặt.
Gọi số học sinh lớp 8B là x bạn (x ∈ N, 0 ≤ x ≤ 50)
Bạn thứ nhất của lớp 8B (bạn Anh) quen 10 + 1 bạn của lớp 8A.
Bạn thứ hai của lớp 8B (bạn Bắc) quen 10 + 2 bạn của lớp 8A.
Bạn thứ ba của lớp 8B (bạn Châu) quen 10 + 3 bạn của lớp 8A.
…………………
Bạn thứ x của lớp 8B (bạn Yến) quen 10 + x bạn của lớp 8A. Mà bạn Yến quen tất cả các bạn lớp 8A nên số học sinh lớp 8A tham gia họp mặt là 10 + x.
Vì có tất cả 50 học sinh tham gia họp mặt nên ta có phương trình:
x + 10 + x = 50 ⇔ 2x = 40 ⇔ x = 20 (tm đk)
Vậy lớp 8A có 20 học sinh, lớp 8B có 30 học sinh dự họp mặt.
Đúng 0
Bình luận (0)
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)Mg + H2SO 4 → MgSO4 + H2S + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
Mg + H2SO 4 → MgSO4 + H2S + H2O.
\(B1.\overset{0}{Mg}+H_2\overset{+6}{S}O_4\rightarrow\overset{2+}{Mg}SO_4+H_2\overset{2-}{S}+H_2O\\ B2+B3.QToxh:Mg\rightarrow Mg^{2+}+2e|\times4\\ QTkhử:S^{+6}+8e\rightarrow S^{2-}|\times1\\ B4.4Mg+5H_2SO_4\rightarrow4MgSO_4+H_2S+4H_2O\)
Đúng 3
Bình luận (3)
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)6. Al + HNO3 → Al(NO3)3+ N2O + H2O.7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3+ MnSO4+ K2SO4 + H2O.8. KMnO4+ HCl → KCl + MnCl2...
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
6. Al + HNO3 → Al(NO3)3+ N2O + H2O.
7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3+ MnSO4+ K2SO4 + H2O.
8. KMnO4+ HCl → KCl + MnCl2 + Cl2+ H2O.
9. K2Cr2O7+ HCl → KCl + CrCl3+ Cl2 + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)3. Mg + H2SO4 → MgSO4 + H2S + H2O.4. Al + HNO3 → Al(NO3)3 + NH4NO3+ H2O.5. Fe3O4+ HNO3 → Fe(NO3)3+ N2O + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
3. Mg + H2SO4 → MgSO4 + H2S + H2O.
4. Al + HNO3 → Al(NO3)3 + NH4NO3+ H2O.
5. Fe3O4+ HNO3 → Fe(NO3)3+ N2O + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)3. Mg + H2SO4→ MgSO4+ H2S + H2O.4. Al + HNO3 → Al(NO3 )3+ NH4NO3 + H2O.5. Fe3O4 + HNO3→ Fe(NO3)3 + N2O + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
3. Mg + H2SO4→ MgSO4+ H2S + H2O.
4. Al + HNO3 → Al(NO3 )3+ NH4NO3 + H2O.
5. Fe3O4 + HNO3→ Fe(NO3)3 + N2O + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)8. KMnO4 + HCl→ KCl + MnCl2 + Cl2 + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
8. KMnO4 + HCl→ KCl + MnCl2 + Cl2 + H2O.










