hoàn thành các chuỗi phản ứng sau
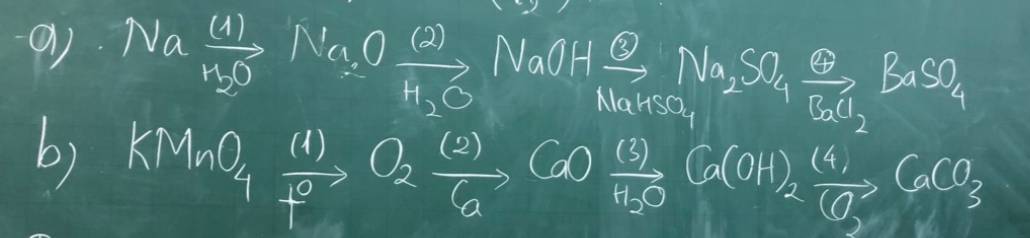
Viết phương trình hoá học của các phản ứng hoàn thành chuỗi phản ứng sau :
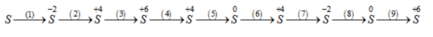
(1) S + H 2 → t ° H 2 S
(2) 2 H 2 S + 3 O 2 → t ° 2S O 2 + 2 H 2 O
(3) S O 2 + Br 2 + 2 H 2 O → t ° H 2 SO 4 + 2HBr
(4) Cu + H 2 SO 4 đặc nóng → Cu SO 4 + S O 2 + 2 H 2 O
(5) S O 2 + 2Mg → S + 2MgO
(6) S + O 2 → t ° S O 2
(7) S O 2 + 6HI → H 2 S + 3 I 2 + 2 H 2 O
(8) H 2 S + Cl 2 → S + 2HCl
(9) S + 6HN O 3 đặc nóng → H 2 SO 4 + 6N O 2 + 2 H 2 O
a)HOÀN THÀNH CÁC CHUỖI PHẢN ỨNG SAU
kMNO4--->O2--->SO3--->H2SO4--->H2--->H20
2KMnO4-to>K2MnO4+MnO2+O2
3O2+2S-to, V2O5->2SO3
SO3+H2O->H2SO4
H2SO4+Fe->FeSO4+H2
2H2+O2-to>2H2O
KMnO4 → K2MnO4 + MnO2 + O2
SO3+ O2-> SO3
SO3 + H2SO4 → H2S3O10
H2SO4+Fe->FeSO4+H2
H2+O2→(to)H2O
Viết phương trình hoá học của các phản ứng, hoàn thành chuỗi biến hoá sau :
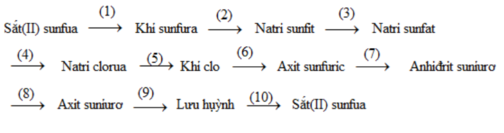
Hoàn thành chuỗi phản ứng sau:
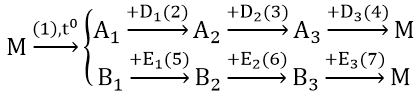
\(1.Cu\left(OH\right)_2\text{ }\left(M\right)\underrightarrow{^{^{t^0}}}CuO\left(A_1\right)+H_2O\left(B_1\right)\)
\(2.CuO+2HCl\left(D_1\right)\rightarrow CuCl_2\left(A_2\right)+H_2O\)
\(3.CuCl_2+2AgNO_3\left(D_2\right)\rightarrow Cu\left(NO_3\right)_2\left(A_3\right)+2AgCl\)
\(4.Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaNO_3\)
\(5.H_2O+SO_3\left(E_1\right)\rightarrow H_2SO_4\left(B_2\right)\)
\(6.H_2SO_4+CuCO_3\left(E_2\right)\rightarrow CuSO_4\left(B_3\right)+CO_2+H_2O\)
\(7.CuSO_4+2KOH\left(E_3\right)\rightarrow Cu\left(OH\right)_2+K_2SO_4\)
Hoàn thành chuỗi phản ứng sau:
(GIÚP VỚI)
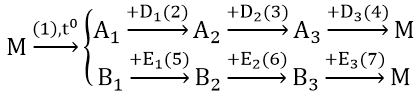
viết PTHH hoàn thành chuỗi phản ứng sau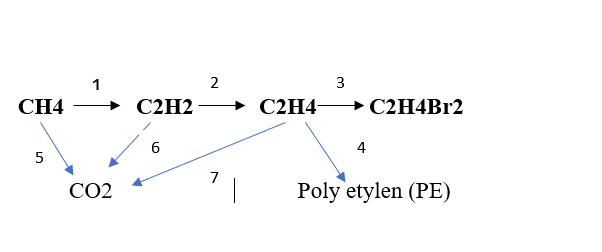
(1) \(2CH_4\underrightarrow{1500^oC,làm.lạnh.nhanh}C_2H_2+3H_2\)
(2) \(C_2H_2+H_2\underrightarrow{t^o,Pd/PbCO_3}C_2H_4\)
(3) \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
(4) \(nCH_2=CH_2\underrightarrow{t^o,p,xt}\left(-CH_2-CH_2-\right)_n\)
(5) \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
(6) \(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
(7) \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Hoàn thành chuỗi phản ứng sau, ghi rõ điều kiện phản ứng nếu có:
Fe --> H2 --> H2O --> H2SO4
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\\ 2H_2+O_2\underrightarrow{t^o}2H_2O\\ SO_3+H_2O\rightarrow H_2SO_4\)
Bài 1.Hoàn thành chuỗi phản ứng sau:
KMnO4![]() O2
O2![]() Fe3O4
Fe3O4![]() Fe
Fe![]() FeCl2
FeCl2
Bài 2. Nêu phương pháp nhận biết các khí không màu đựng trong ba lọ mất nhãn.
Khí oxi, khí hidro, khí cacbonnic
Bài 3. Phân biệt phản ứng thế và phản ứng phân hủy, phản ứng hóa hợp? Mỗi loại phản ứng cho 3 ví dụ?
Bài 4. Cho 13 gam kẽm vào 200ml dung dịch HCl đến phản ứng hoàn toàn thu được FeCl2 và khí H2
a) Viết phương trình hóa học xảy ra
b) Tính thể tích khí thu được ở điều kiện tiêu chuẩn
c) Tính khối lượng muối FeCl2 thu được
d) Tính nồng độ mol của dung dịch thu được sau phản ứng?
Bài 5.Cho 3,6 gam một kim loại R có hóa trị II tác dụng hết với khí oxi đun nóng sau phản ứng thu được 6 gam oxit. Xác định tên kim loại R
Bài 6. Hòa tan hoàn toàn 10g CaCO3 vào dung dịch HCl 20% . Tính nồng độ % dung dịch thu được sau phản ứng?
Câu 7. Cho sắt tác dụng vừa đủ với 182,5 gam dung dịch HCl 5% đến khi phản ứng kết thúc thu được V lít khí ở đktc?
a.Viết phương trình hóa học xảy ra?
b. Tính khối lượng sắt đã phản ứng và tính V?
c.Tính nồng độ phần trăm của dung dịch muối thu được?
Hoàn thành chuỗi sơ đồ phản ứng sau :
FeS2 ---> SO2--->SO3--->H2SO4