Hãy xác định vị trí của aluminium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion aluminium từ nguyên tử aluminium

Những câu hỏi liên quan
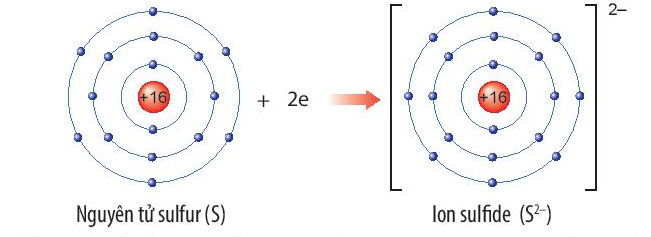
Xác định vị trí của sulfur trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion sulfide (S2-) từ nguyên tử sulfur
Nguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).
Đúng 0
Bình luận (0)
Lập phương trình hóa học của các phản ứng sau. Cho biết tỉ lệ số nguyên tử, số phân tử của chất trong phản ứng? :
a) Đốt Aluminium trong oxygen tạo ra Aluminium oxide.
b) Nung Aluminium hydroxide tạo ra Aluminium oxide và nước
a) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
tỉ lệ: \(4:3:2\)
b) \(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\uparrow\)
tỉ lệ: \(2:1:3\)
Đúng 2
Bình luận (0)
Cho biết vị trí trong bảng tuần hoàn, số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố N, C, O và vẽ sơ đồ hình thành liên kết trong các phân tử ở hình sau:

- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
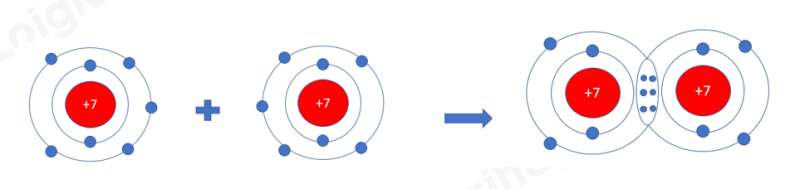
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
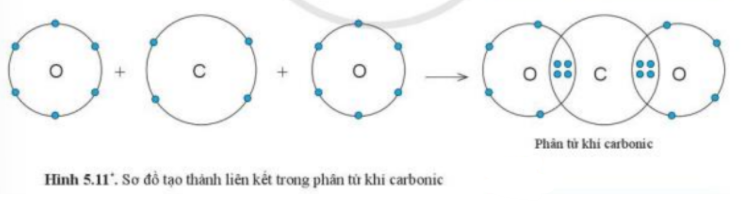
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung
Đúng 0
Bình luận (0)
Cho biết thành phần phân tử của các chất sau: - Khí chlorine gồm 2 nguyên tử chlorine. - Nitric acid gồm 1 nguyên tử hydrogen, 1 nguyên tử nitrogen và 3 nguyên tử oxygen. - Aluminium gồm 1 nguyên tử aluminium. - Potassium sulfate gồm 2 nguyên tử potassium, 1 nguyên tử sulfur và 4 nguyên tử oxygen. - Khí ozone gồm 3 nguyên tử oxygen. - Muối ăn gồm 1 nguyên tử sodium và 1 nguyên tử chlorine. - Khí carbon dioxide gồm 1 nguyên tử carbon và 2 nguyên tử oxygen. - Khí nitrogen gồm 2 nguyên tử nitrogen....
Đọc tiếp
Cho biết thành phần phân tử của các chất sau: - Khí chlorine gồm 2 nguyên tử chlorine. - Nitric acid gồm 1 nguyên tử hydrogen, 1 nguyên tử nitrogen và 3 nguyên tử oxygen. - Aluminium gồm 1 nguyên tử aluminium. - Potassium sulfate gồm 2 nguyên tử potassium, 1 nguyên tử sulfur và 4 nguyên tử oxygen. - Khí ozone gồm 3 nguyên tử oxygen. - Muối ăn gồm 1 nguyên tử sodium và 1 nguyên tử chlorine. - Khí carbon dioxide gồm 1 nguyên tử carbon và 2 nguyên tử oxygen. - Khí nitrogen gồm 2 nguyên tử nitrogen. - Nước gồm 2 nguyên tử hydrogen và 1 nguyên tử oxygen. - Iron gồm 1 nguyên tử iron. - Than chì gồm 1 nguyên tử carbon. - Giấm ăn gồm 2 nguyên tử carbon, 4 nguyên tử hydrogen và 2 nguyên tử oxygen. a) Hãy cho biết chất nào là đơn chất, chất nào là hợp chất? b) Tính phân tử khối của các chất.
Xác định số nguyên tử có trong:
a) 2 mol nguyên tử nhôm (aluminium).
b) 1,5 mol nguyên tử carbon.
Xác định số nguyên tử có trong:
a) 2 mol nguyên tử nhôm (aluminium).
-> 2.6,022.1023= 12,044.1023 (ngtu)
b) 1,5 mol nguyên tử carbon.
-> 1,5. 6,022.1023= 9,033.1023 (ngtu)
Đúng 2
Bình luận (0)
a. 2 mol nguyên tử nhôm (aluminium).
2.6,022.1023 = 12,044.1023(nguyên tử)
b) 1,5 mol nguyên tử carbon.
1,5.6,022.1023 =9,033.1023(nguyên tử)
Đúng 0
Bình luận (0)
(1 điểm) Nguyên tử nguyên tố aluminium có 13 proton trong hạt nhân.
a) Viết cấu hình electron nguyên tử của nguyên tố aluminium.
b) Cho biết nguyên tố aluminium nằm ở đâu trong bảng tuần hoàn các nguyên tố hóa học.
a) Ta có: p = e; p = 13
=> p = e = 13
- Cấu hình electron trong nguyên tử của nguyên tố Aluminium (Al) là:
+) Lớp thứ nhất: 2 electron
+) Lớp thứ hai: 8 electron
+) Lớp thứ ba: 3 3lectron
b) Vị trí của nguyên tố Aluminium trong bảng tuần hoàn các nguyên tố hóa học:
- Ô: 13
- Chu kì: 3
- Nhóm: IIIA
Đúng 0
Bình luận (0)
Đốt cháy hết 0,54 gam Al trong không khí thu được aluminium oxide theo sơ đồ phản ứng:
Al + O2 → Al2O3
Lập phương trình hoá học của phản ứng rồi tính:
a) Khối lượng aluminium oxide tạo ra.
b) Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn.
Phương trình hoá học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
n Al = mAl : M Al = 0,54 : 27 = 0,02 mol
a) Từ phương trình hóa học ta có:
n Al2O3 = ½ n Al = 0,02 : 2 = 0,01 mol
n Al2O3 = 0,01 x 102 = 10,2 gam
b) theo phương trình hóa học ta có:
n O2 = ¾ n Al = ¾ x 0,02 = 0,015 mol
V O2 (đkc) = 0,015 x 24,79 = 0,37185 (lít)
Đúng 1
Bình luận (0)
\(PTHH:4Al+3O_2\left(t^o\right)\rightarrow2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\Rightarrow n_{Al}=\dfrac{2}{4}.0,02=0,01\left(mol\right);n_{O_2}=\dfrac{3}{4}.0,02=0,15\left(mol\right)\\ a,m_{Al_2O_3}=0,01.27=0,27\left(g\right)\\ b,V_{O_2\left(đkc\right)}=0,15.24,79=3,7185\left(l\right)\)
Đúng 0
Bình luận (0)
Một mol nguyên tử Aluminium (Al) có chứa bao nhiêu nguyên tử aluminium
Tổng số hạt trong nguyên tử của một nguyên tố R là 40. Số khối của R < 28. a- Tìm số proton, điện tích hạt nhân, viết cấu hình electron và xác định vị trí của R trong bảng hệ thống tuần hoàn. b- R có thể tạo ra ion nào? Viết cấu hình electron của ion đó. c- Cho m gam kim loại R tác dụng vừa đủ với V ml dung dịch H2SO4 loãng 1M vừa đủ thu được 4,48 lít khí H2 (đktc). Tính m và V.
















