Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 2.

Những câu hỏi liên quan
Nêu hiện tượng quan sát được, giải thích và viết phương trình hóa học của các phản ứng xảy ra trong ba thí nghiệm trên
Thí nghiệm 1
- Hiện tượng
Miếng Na tan dần.
Có khí thoát ra.
Miếng giấy lọc có tẩm phenolphtalein đổi thành màu đỏ.
- Phương trình hóa học: 2Na + H2O → 2NaOH + H2.
- Giải thích: Do Na phản ứng rất mạnh với nước tạo dung dịch bazo làm phenol chuyển hồng, phản ứng giải phóng khí H2.
Thí nghiệm 2
- Hiện tượng: Mẩu vôi nhão ra và tan dần
Phản ứng tỏa nhiều nhiệt.
Dung dịch đổi quỳ tím thành màu xanh (nếu dùng phenolphtalein thì đổi thành màu đỏ)
- Phương trình hóa học: CaO + H2O → Ca(OH)2.
- Giải thích: CaO tan trong nước tạo dung dịch Ca(OH)2 có tính bazo làm quỳ tím chuyển xanh (phenolphtalein chuyển hồng), phản ứng tỏa nhiệt.
Thí nghiệm 3
- Hiện tượng: Photpho cháy sáng.
Có khói màu trắng tạo thành.
Sau khi lắc khói màu trắng tan hết.
Dung dịch làm quỳ tím chuyển thành màu đỏ.
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4.
- Giải thích:
Photpho đỏ phản ứng mạnh với khí Oxi tạo khói trắng là P2O5. P2O5 là oxit axit, tan trong nước tạo dung dịch axit H3PO4 là quỳ tím chuyển đỏ.
Đúng 0
Bình luận (0)
Axit fomic tác dụng với AgNO3 trong dung dịch NH3 tạo ra kết tủa bạc kim loại. Dựa vào cấu tạo phân tử của axit fomic để giải thích, viết phương trình hóa học của phản ứng.
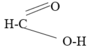
Do trong phân tử HCOOH có nhóm –CHO nên HCOOH phản ứng với AgNO3/NH3 như là một anđehit.
HCOOH + 2AgNO3 + 4NH3 + H2O → (NH4)2CO3 + 2Ag + 2NH4NO3
Đúng 0
Bình luận (0)
Có 5 ống nghiệm được kí hiệu ngẫu nhiên A, B, C, D, E. Mỗi ống nghiệm chứa một trong các dung dịch AgNO3, ZnCl2, HCl, Na2CO3, KCl. Tiến hành các thí nghiệm và thu được kết quả như sau: – Thí nghiệm 1: B tác dụng với C có khí thoát ra. – Thí nghiệm 2: C tác dụng với D hoặc với E đều có kết tủa tạo thành – Thí nghiệm 3: B không phản ứng với E. Xác định A, B, C, D, E và viết phương trình hóa học của phản ứng xảy ra.
Đọc tiếp
Có 5 ống nghiệm được kí hiệu ngẫu nhiên A, B, C, D, E. Mỗi ống nghiệm chứa một trong các dung dịch AgNO3, ZnCl2, HCl, Na2CO3, KCl. Tiến hành các thí nghiệm và thu được kết quả như sau:
– Thí nghiệm 1: B tác dụng với C có khí thoát ra.
– Thí nghiệm 2: C tác dụng với D hoặc với E đều có kết tủa tạo thành
– Thí nghiệm 3: B không phản ứng với E. Xác định A, B, C, D, E và viết phương trình hóa học của phản ứng xảy ra.
B tác dụng với C có khí thoát ra

Pt: 2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
Na2CO3 + ZnCl2 → ZnCO3↓ + 2NaCl
Na2CO3 + 2AgNO3 → Ag2CO3↓ + 2NaNO3
Đúng 0
Bình luận (0)
Dẫn hỗn hợp khí X gồm axetilen và anđehit axetic vào dung dịch AgNO3 trong ammoniac thấy tạo ra kết tủa gồm hai chất. Lấy kết tủa cho vào dung dịch axit HCl dư thấy có khí bay lên và còn một phần không tan Y. Hòa tan Y trong dung dịch HNO3 đặc thấy có khí màu nâu bay lên. Viết phương trình hóa học của các phản ứng xảy ra để giải thích quá trình thí nghiệm trên.
Đọc tiếp
Dẫn hỗn hợp khí X gồm axetilen và anđehit axetic vào dung dịch AgNO3 trong ammoniac thấy tạo ra kết tủa gồm hai chất. Lấy kết tủa cho vào dung dịch axit HCl dư thấy có khí bay lên và còn một phần không tan Y. Hòa tan Y trong dung dịch HNO3 đặc thấy có khí màu nâu bay lên. Viết phương trình hóa học của các phản ứng xảy ra để giải thích quá trình thí nghiệm trên.
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3
Lọc kết tủa: AgC≡CAg và Ag cho vào HCl chỉ có AgC≡CAg phản ứng:
AgC≡CAg + 2HCl → HC≡CH↑ + 2AgCl↓
Phần không tan Y là Ag và AgCl, hòa tan trong HNO3 đặc chỉ có Ag phản ứng:
Ag + 2HNO3 → AgNO3 + NO2nâu↑ + H2O
Đúng 0
Bình luận (0)
thí nghiệm ở hình 2.13 chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ . hãy quan sát , mô tả và giải thích hiện tượng xảy ra trong thí nghiệm . Viết phương trình hóa học của phản ứng xảy ra .
hình 2.13 sách giáo khoa Hóa Học 11 chương trình chuẩn trang 49
Khi đun nóng khay sắt chứa p đỏ và p trắng (lưu ý rằng p trắng để xa nguổn nhiệt hơn) thì miếng p trắng cháy sáng, còn miếng p đỏ tuy gần nguồn nhiệt nhưtìg vẫn chưa bốc cháy, chứng tỏ p trắng hoạt động hóa học mạnh hơn p đỏ.
4P + 502 -> 2P2O5
Đúng 0
Bình luận (0)
Nhỏ chậm nước vào nhôm cacbua
Mô tả hiện tượng và viết các phương trình hóa học của các phản ứng để minh họa cho thí nghiệm
Hiện tượng thí nghiệm: Al4C3 tan dần, có hiện tượng sủi bọt khí, xuất hiện kết tủa keo trắng.
Al4C3 + 12H2O → 4Al(OH)3 ↓ + 3CH4 ↑
Đúng 0
Bình luận (0)
Dẫn từ từ 3,36 lít hỗn hợp gồm etilen và propilen (đktc) vào dung dịch brom thấy dung dịch bị nhạt màu và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 4,90gam. Viết các phương trình hóa học và giải thích các hiện tượng ở thí nghiệm trên.
Cho H2SO4 đặc vào cốc chứa một ít đường saccarozo, thu hỗn hợp khí sau phản ứng rồi sục vào dung dịch Ca(OH)2 dư. Nêu hiện tượng xảy ra trong các thí nghiệm và viết phương trình hóa học của các phản ứng xảy ra
Lúc đầu: C12H22O11 + H2SO4 → 12C(đen) + H2SO4.11H2O
Sau đó: C12H22O11 + 24H2SO4 → 12CO2↑ + 24SO2↑ + 35H2O
Khi nhỏ axit H2SO4 đặc vào saccarozo, ta thấy đường nhanh chóng hóa đen, sau đó khối rắn tăng thể tích rất nhanh và thoát khí mùi hắc (SO2). Quan sát phương trình ta thấy chỉ 1 mol đường nhưng tạo ra những (12 + 24 = 35) mol khí, vì vậy thể tích khối rắn tăng lên nhanh.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Khí (CO2 + SO2) sục vào dung dịch Ca(OH)2 dư ta thấy xuất hiện kết tủa trắng, kết tủa tăng dần đến tối đa và không thay đổi.
Đúng 1
Bình luận (0)
Nhỏ chậm dung dịch NaHSO4 vào dung dịch Na2CO3
Mô tả hiện tượng và viết các phương trình hóa học của các phản ứng để minh họa cho thí nghiệm
Hiện tượng thí nghiệm: Ban đầu không có hiện tượng, sau một thời gian thấy xuất hiện sủi bọt khí.
NaHSO4 + Na2CO3 → Na2SO4 + NaHCO3 + H2O
NaHSO4 + NaHCO3 → Na2SO4 + H2O + CO2 ↑
Đúng 0
Bình luận (0)
Nêu hiện tượng và viết phương trình hóa học cho các phản ứng trong các thí nghiệm sau :
a) Cho dd Na2S2O3 vào dd H2SO4 loãng
b) cho dd HCl vào dd Fe(NO3)2
a) HT: Có chất rắn màu vàng lặng xuống đáy bình đồng thời có chất khí mùi hắc thoát ra
PT: \(Na_2S_2O_3+H_2SO_4\rightarrow Na_2SO_4+S\downarrow+SO_2\uparrow+H_2O\)
b) HT: Có chất khí không màu thoát ra sau đó hoá nâu trong không khí
PT: \(9Fe\left(NO_3\right)_2+12HCl\rightarrow5Fe\left(NO_3\right)_3+4FeCl_3+3NO\uparrow+6H_2O\)
\(2NO+O_2\rightarrow2NO_2\)
Đúng 4
Bình luận (0)
a) HT: Có chất rắn màu vàng lặng xuống đáy bình đồng thời có chất khí mùi hắc thoát ra
PT: \(Na_2S_2O_3+H_2SO_4\rightarrow Na_2SO_4+S\downarrow+SO_2\uparrow+H_2O\)
b) HT: Không có hiện tượng gì xảy ra











