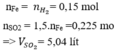Hòa tan 5,4gam Al vào trong dung dịch H₂SO₄. Tính thể tích khí H₂ sinh ra (ở đktc)

Những câu hỏi liên quan
1/ Hòa tan m (g) Na2O vào nước thu được dung dịch A. Trung hòa A cần 200ml dung dịch dồm HCl 0,5M và H2SO4 0,25M. Tính giá trị của m ?2/ Trộn 100ml dung dịch H2SO4 1,1M với 100ml dung dịch NaOH 1M thu được dung dịch A. Cho vào dung dịch A 1,35g Al thì thu được thể tích H2 ở đktc là bao nhiêu ?3/ Dung dịch X có thể tích 300ml chứ Ca(OH)2 0,3M có thể hấp thụ tối đa bao nhiêu lít CO2 ở đktc ?4/ Cho 2,3 g một kim loại hóa trị I tác dụng với nước sinh ra 1,12 lít khí H2 ở đktc. Xác định kim loại đó.
Đọc tiếp
1/ Hòa tan m (g) Na2O vào nước thu được dung dịch A. Trung hòa A cần 200ml dung dịch dồm HCl 0,5M và H2SO4 0,25M. Tính giá trị của m ?
2/ Trộn 100ml dung dịch H2SO4 1,1M với 100ml dung dịch NaOH 1M thu được dung dịch A. Cho vào dung dịch A 1,35g Al thì thu được thể tích H2 ở đktc là bao nhiêu ?
3/ Dung dịch X có thể tích 300ml chứ Ca(OH)2 0,3M có thể hấp thụ tối đa bao nhiêu lít CO2 ở đktc ?
4/ Cho 2,3 g một kim loại hóa trị I tác dụng với nước sinh ra 1,12 lít khí H2 ở đktc. Xác định kim loại đó.
Hòa tan hoàn toàn 0,56g sắt bằng dung dịch H\(_2\)SO\(_4\) loãng 19,6 % vừa đủ
a, Viết phương trình hóa học
b, Tính khối lượng muối tạo thành và thể tích khí hidro sinh ra (đktc)
c, Cần bao nhiêu gam dung dịch H\(_2\)SO\(_4\) nói trên để hòa tan sắt
a) \(Pt:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{Fe}=\dfrac{0,56}{56}=0,01mol\)
Theo pt: \(n_{FeSO_4}=n_{Fe}=0,01mol\)
\(\Rightarrow m_{FeSO_4}=0,01.152=1,52g\)
Theo pt: \(n_{H_2}=n_{Fe}=0,01mol\)
\(\Rightarrow V_{H_2}=0,01.22,4=0,224lít\)
c) \(Theopt:nH_2SO_4=n_{Fe}=0,01mol\)
\(\Rightarrow m_{H_2SO_4}=0,01.98=0,98g\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,98.100}{19,6}=5g\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 39 gam kim loại kall vào nước thu được
200ml dung dich.
a. Tinh thể tích khi H, sinh ra (ở đktc). b. Tính nồng độ mol/lit của dung dịch thu được.
c. Tính thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn lượng khi H2 thu được ở trên.Hòa tan hoàn toàn 39 gam kim loại kall vào nước thu được
200ml dung dich.
a. Tinh thể tích khi H, sinh ra (ở đktc). b. Tính nồng độ mol/lit của dung dịch thu được.
c. Tính thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn lượng k...
Đọc tiếp
Hòa tan hoàn toàn 39 gam kim loại kall vào nước thu được 200ml dung dich. a. Tinh thể tích khi H, sinh ra (ở đktc). b. Tính nồng độ mol/lit của dung dịch thu được. c. Tính thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn lượng khi H2 thu được ở trên.Hòa tan hoàn toàn 39 gam kim loại kall vào nước thu được 200ml dung dich. a. Tinh thể tích khi H, sinh ra (ở đktc). b. Tính nồng độ mol/lit của dung dịch thu được. c. Tính thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn lượng khi H2 thu được ở trên.Hòa tan hoàn toàn 39 gam kim loại kall vào nước thu được 200ml dung dich. a. Tinh thể tích khi H, sinh ra (ở đktc). b. Tính nồng độ mol/lit của dung dịch thu được. c. Tính thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn lượng khi H2 thu được ở trên.
\(n_K=\dfrac{39}{39}=1\left(mol\right)\\ 2K+2H_2O\rightarrow2KOH+H_2\\ n_{H_2}=\dfrac{1}{2}=0,5\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,5.22,4=11,2\left(l\right)\\ b,n_{KOH}=n_K=1\left(mol\right)\\ C_{MddKOH}=\dfrac{1}{0,2}=5\left(M\right)\\ c,2H_2+O_2\rightarrow\left(t^o\right)2H_2O\\ n_{O_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 5,41g hỗn hợp 2 kim loại Al và Zn bằng dung dịch HCl loãng thu được dung dịch X. Cô cạn dung dịch X được 17,48g muối khan. Tính thể tích khí H2 sinh ra (ở đktc) .
\(5,41g\left\{{}\begin{matrix}Al\\Zn\end{matrix}\right.+HCl->\left\{{}\begin{matrix}AlCl3\\ZnCl2\end{matrix}\right.+H2\)
Ta có :
\(\left\{{}\begin{matrix}27x+65y=5,41\\133,5x+136y=17,48\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,08\\y=0,05\end{matrix}\right.\)
Bảo toàn e :
\(3x+2y=2.nH2\)
\(\Rightarrow nH2=0,17\left(mol\right)\)
\(\Rightarrow V=0,17.22,4=3,808\left(l\right)\)
Đúng 3
Bình luận (1)
Câu 3 : Hòa tan hoàn toàn 4,8g Mg vào dung dịch HCl 10,95%
a) Viết phương trình
b) Tính khối lượng dung dịch HCl cần dùng
c) Tính thể tích khí sinh ra ở đktc
d) Tính nồng độ % các chất trong dung dịch tạo thành
Câu 3 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
a) Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
b) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
\(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(m_{ddHCl}=\dfrac{14,6.100}{10,95}=133,3\left(g\right)\)
c) \(n_{H2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
d) \(n_{MgCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{MgCl2}=0,2.95=19\left(g\right)\)
\(m_{ddspu}=4,8+133,3-\left(0,2.2\right)=137,7\left(g\right)\)
\(C_{MgCl2}=\dfrac{19.100}{137,7}=13,8\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 4,8g Mg vào dung dịch HCl 10,95% a) Viết phương trình b) Tính khối lượng dung dịch HCl cần dùng c) Tính thể tích khí sinh ra ở đktc d) Tính nồng độ % các chất trong dung dịch tạo thành (Cho : Mg = 24; Cl = 35,5; H = 1
hòa tan 5,4 gam nhôm vào 250ml nước dung dịch HCL thu được sản phẩm là muối nhôm clorua và khí hidro a) viết phương trình phản ứng hoá học xảy ra b) tính thể tính khí thu được ở đktc c) tính nồng độ mol của dung dịch axit HCL ban đầu ( cho AL =27,H=1, Cl=35,5
Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
a) Pt : 2Al + 6HCl → 2AlCl3 + 3H2\(|\)
2 6 2 2
0,2 0,6 0,2
b) Số mol của khí hidro
nH2= \(\dfrac{0,2.2}{2}=0,2\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
c) Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,2.6}{2}=0,6\left(mol\right)\)
250ml = 0,25l
Nồng độ mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}=\dfrac{0,6}{0,25}=2,4\left(M\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
a, 2Al +6HCl-> 2AlCl3 +3H2
b, nAl=5,4/27= 0,2mol
2Al+ 6HCl->2AlCl3+3H2
0,2. 0,6. 0,2. 0,3
V(H2)= 0,3.22,4=6,72lit
c, C(HCl) =n/V= 0,6/0,25=2,4M
Đúng 2
Bình luận (0)
Hòa tan m gam Fe trong dung dịch
H
2
S
O
4
loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam sắt này vào dung dịch
H
2
S
O
4
đặc, nóng thì thể tích khí (đktc) sinh ra bằng A. 2,24 lít B. 5,04 lít C. 3,36 lít D. 10,08 lít
Đọc tiếp
Hòa tan m gam Fe trong dung dịch H 2 S O 4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam sắt này vào dung dịch H 2 S O 4 đặc, nóng thì thể tích khí (đktc) sinh ra bằng
A. 2,24 lít
B. 5,04 lít
C. 3,36 lít
D. 10,08 lít
Hòa tan 2,8 sắt bằng dung dịch hcl 2m vừa đủ a, tính thể tích khí hidro sinh ra ở đktc b, tính thể tích dung dịch hcl cần dùng
\(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
PT :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,05 0,1 0,05
\(a,V_{H_2}=0,05.22,4=1,12\left(l\right)\)
\(b,V_{HCl}=\dfrac{n}{C_M}=\dfrac{0,1}{2}=0,05\left(l\right)\)
Đúng 3
Bình luận (0)