hoà tan hoàn toàn 1,12g bột sắt bằng dung dịch H2SO4 loãng dư. Sau phản ứng thu được Vlít khí H2(đktc)
a:tính V
b:nếu hoà tan cũng 1,12g sắt trên bằng H2SO4 đặc,nóng,dư thì thu được V1 lít SO2 là sản phẩm khử duy nhất . Tính V1
Hoà tan hoàn toàn 2,44 gam hỗn hợp bột X gồm F e x O y và Cu bằng dung dịch H 2 S O 4 đặc nóng (dư). Sau phản ứng thu được 0,504 lít khí S O 2 (sản phẩm khử duy nhất, ở đktc) và dung dịch chứa 6,6 gam hỗn hợp muối sunfat. Tính phần trăm khối lượng của Cu trong X.
Có hỗn hợp gồm Al và một oxit sắt. Sau phản ứng nhiệt nhôm hoàn toàn thu được 96,6 g chất rắn.
- Hoà tan chất rắn trong NaOH dư thu được 6,72 lít khí đktc và còn lại một phần không tan A.
- Hoà tan hoàn toàn A trong H2SO4 đặc nóng được 30,24 lít khí B ở đktc.
Công thức của sắt oxit là:
A. Fe2O3
B. Fe3O4
C. FeO
D. Không xác định
Đáp án B
Gọi công thức của oxit sắt là FexOy.
Vì hòa tan chất rắn sau phản ứng vào dung dịch NaOH dư có xuất hiện khí nên hỗn hợp sau phản ứng nhiệt nhôm gồm Fe, A12O3 và Al dư.
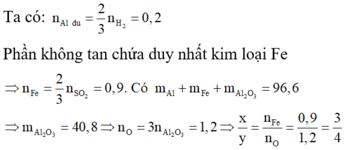
Trộn 10,8 gam bột Al với 34,8 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hoà tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 10,752 lít khí H2 (đktc). Hiệu suất của phản ứng nhiệt nhôm là
A. 80%.
B. 90%.
C. 70%.
D. 60%.
Đáp án A
![]()
8Al + 3Fe3O4 9Fe + 4Al2O3
![]()
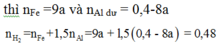
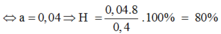
Đáp án A
Cho khí CO dư đi qua 13,92 gam một oxit sắt đã nung nóng, sau khi phản ứng thu được khí A và chất rắn B. Hòa tan hoàn toàn B trong dung dịch H2SO4 loãng dư, sau phản ứng hoàn toàn thu được 4,032 lít H2 (đktc). Xác định công thức hóa học của oxit sắt?
\(n_{H_2}=\dfrac{4,032}{22,4}=0,18\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,18 <------------------------ 0,18
\(\rightarrow n_O=\dfrac{13,92-0,18.56}{16}=0,24\left(mol\right)\)
CTHH: FexOy
=> x : y = 0,18 : 0,24 = 3 : 4
CTHH Fe3O4
Cho bột sắt dư vào dung dịch H2SO4 đặc nóng, thu được a gam muối và V lít khí SO2 duy nhất. Mặt khác, cho bột sắt dư vào dung dịch H2SO4 loãng, thu được b gam muối và V lít khí H2. Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở cùng điều kiện. Mối quan hệ giữa a và b là
A. a<b
B. a=1,5b
C. a=b
D. a>b
Trộn 10,8 gam bột Al với 34,8 gam bột F e 3 O 4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hoà tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H 2 S O 4 loãng (dư), thu được 10,752 lít khí H 2 (đktc). Tính hiệu suất của phản ứng nhiệt nhôm.
Hòa tan hoàn toàn a gam sắt vào dung dịch H2SO4 loãng thu được 4,48 lít khí. Mặt khác cũng hòa tan hết a gam sắt vào H2SO4 đặc nóng dư được V lít khí. Cho khí này phản ứng với dung dịch KMnO4 2M vừa đủ. Viết các phương trình phản ứng, tính V và V dd KMnO4 2M
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (1)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\) (2)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (3)
Ta có: \(n_{H_2}=0,2\left(mol\right)\)
Theo PT (1): \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
Theo PT (2): \(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Theo PT (3): \(n_{KMnO_4}=\dfrac{2}{5}n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow V_{KMnO_4}=\dfrac{0,12}{2}=0,06\left(l\right)\)
Bạn tham khảo nhé!
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\:\right)=n_{H_2}\)
\(\Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)
Giúp mk với ạ: Cho 33,2g hỗn hưp X gồm Cu, Mg, Al tác dông vừa đủ với dung dịch H2SO4 loãng thu được 22,4 lít khí ở đktc và chất rắn không tan B. Cho B hoà tan hoàn toàn vào dung dịch H2SO4 đặc, nóng dư thu được 4,48 lít khí SO2(đktc). Khối lượng mỗi kim loại trong hỗn hựp X lần lượt là: A. 13,8g; 7,6; 11,8 B. 11,8; 9,6; 11,8 C.12,8; 9,6; 10,8 D. kết quả khác
\(n_{SO_2}=0.2\left(mol\right)\)
Bảo toàn e :
\(n_{Cu}=n_{SO_2}=0.2\left(mol\right)\)
\(m_{Cu}=0.2\cdot64=12.8\left(g\right)\)
\(m_{Mg}+m_{Al}=24x+27y=33.2-12.8=20.4\left(g\right)\left(1\right)\)
\(n_{H_2}=x+1.5y=1\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):x=y=0.4\)
\(m_{Mg}=0.4\cdot24=9.6\left(g\right)\)
\(m_{Al}=10.8\left(g\right)\)
=> C