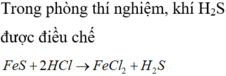Điều chế của H2S và H2SO4

Những câu hỏi liên quan
Từ những chất sau : Cu, S,
H
2
S
,
O
2
,
Na
2
SO
3
,
H
2
SO
4
đặc và dung dịch ...
Đọc tiếp
Từ những chất sau : Cu, S, H 2 S , O 2 , Na 2 SO 3 , H 2 SO 4 đặc và dung dịch H 2 SO 4 loãng, hãy viết PTHH của phản ứng điều chế SO 2
Hướng dẫn. Các phản ứng điều chế
H 2 SO 4 đặc tác dụng với Cu.
Cu + H 2 SO 4 đặc → Cu SO 4 + SO 2 + H 2 O
H 2 SO 4 đặc tác dụng với S.
S + 2 H 2 SO 4 → 3 SO 2 + 2 H 2 O
Đốt cháy S trong oxi hoặc trong không khí.
S + O 2 → SO 2
Đốt cháy H 2 S trong oxi hoặc trong không khí.
2 H 2 S + 3 O 2 → 2 SO 2 + 2 H 2 O
Dung dịch H 2 SO 4 loãng tác dụng với Na 2 SO 3 ở trạng thái rắn hoặc dung dịch.
Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 O + SO 2
Đúng 0
Bình luận (0)
Viết các phương trình phản ứng chỉ ra: 2 cách điều chế HCl, H2S, H3PO4, HNO3, H2SO4
| HCl | H2S | H3PO4 | HNO3 | H2SO4 | |
| AgNO3 | kt trắng | kt đen | kt vàng | - | kt trắng |
| BaCl2 | - | - | kt trắng | ||
HCl + AgNO3 -> HNO3 + AgCl
H2S + AgNO3 -> HNO3 + Ag2S
H3PO4 + AgNO3 -> HNO3 + Ag3PO4
H2SO4 + AgNO3 -> HNO3 + Ag2SO4
BaCl2 + H2SO4 -> BaSO4 + HCl
Đúng 2
Bình luận (0)
khi làm thí nghiệm điều chế các khí H2S và khí Cl2.Một học sinh đề xuất dùng H2SO4 đặc để làm khô hai khí này.Hãy cho biết quan điểm của em về đề xuất trên.Giải thích và viết phương trình phản ứng nếu có
H2SO4 làm khô được khí Cl2 nhưng làm khô được H2S bởi :
\(3H_2S + H_2SO_4 \to 4SO_2 + 4H_2O\)
Đúng 2
Bình luận (0)
Câu 1: Chọn câu đúng
A. Cho CuS tác dụng với H2SO4 loãng để điều chế H2S ở PTN
B.H2S có tính axit yếu hơn H2SO4
C. H2S ko làm mất màu dd BR2
D. H2S chỉ có tính axit
Câu 1: Chọn câu đúng
A. Cho CuS tác dụng với H2SO4 loãng để điều chế H2S ở PTN
B.H2S có tính axit yếu hơn H2SO4
C. H2S ko làm mất màu dd BR2
D. H2S chỉ có tính axit
Đúng 0
Bình luận (0)
Có thể điều chế lưu huỳnh từ khí SO 2 và H 2 S . Viết PTHH của phản ứng.
Trong các axit sau đây: HCl, HF, HI, HBr,
H
N
O
3
,
H
3
P
O
4
,
H
2
S
. Có bao nhiêu axit có thể điều chế được bằng cách cho tinh thể muối tương ứng tác dụng với
H
2
S
O
4
đặc, nóng: A. 5 B...
Đọc tiếp
Trong các axit sau đây: HCl, HF, HI, HBr, H N O 3 , H 3 P O 4 , H 2 S . Có bao nhiêu axit có thể điều chế được bằng cách cho tinh thể muối tương ứng tác dụng với H 2 S O 4 đặc, nóng:
A. 5
B. 4
C. 2
D. 3
Trong các axit sau đây: HCl, HF, HI, HBr, HNO3,H3PO4,H2S. Có bao nhiêu axit có thể điều chế được bằng cách cho tinh thể muối tương ứng tác dụng với H2SO4 đặc, nóng A. 3 B. 4 C. 2 D. 5
Đọc tiếp
Trong các axit sau đây: HCl, HF, HI, HBr, HNO3,H3PO4,H2S. Có bao nhiêu axit có thể điều chế được bằng cách cho tinh thể muối tương ứng tác dụng với H2SO4 đặc, nóng
A. 3
B. 4
C. 2
D. 5
Đáp án B
Axit HCl, HF, HI, HBr, HNO3,H3PO4,H2Schỉ có tính oxi hóa => không phản ứng ngược trở lại với H2SO4 . Nên có thể điều chế được bằng cách cho tinh thể muối của nó tác dụng với H2SO4 đặc, nóng.
Axit HI, HBr, H2S chứa ion I - , B r - và S 2 - có tính khử sẽ tác dụng ngược trở lại với H2SO4 , Do vậy không thể thu được HI, HBr và H2S
Đúng 0
Bình luận (0)
Trong các axit sau đây: HCl, HF, HI, HBr, HNO3,H3PO4,H2S. Có bao nhiêu axit có thể điều chế được bằng cách cho tinh thể muối tương ứng tác dụng với H2SO4 đặc, nóng A. 3 B. 4 C. 2 D. 5
Đọc tiếp
Trong các axit sau đây: HCl, HF, HI, HBr, HNO3,H3PO4,H2S. Có bao nhiêu axit có thể điều chế được bằng cách cho tinh thể muối tương ứng tác dụng với H2SO4 đặc, nóng
A. 3
B. 4
C. 2
D. 5
Axit HCl, HF, HI, HBr, HNO3,H3PO4,H2Schỉ có tính oxi hóa → không phản ứng ngược trở lại với H2SO4 . Nên có thể điều chế được bằng cách cho tinh thể muối của nó tác dụng với H2SO4 đặc, nóng.
Axit HI, HBr, H2S chứa ion I - , Br - và S 2 - có tính khử sẽ tác dụng ngược trở lại với H2SO4 , Do vậy không thể thu được HI, HBr và H2S
![]()
Đáp án B
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, khí H2S được điều chế từ phản ứng nào của A. CuS + dung dịch HCl loãng B. FeS + dung dịch HCl loãng C. FeS + dung dịch H2SO4 đặc,
t
o
D. S+ H2
Đọc tiếp
Trong phòng thí nghiệm, khí H2S được điều chế từ phản ứng nào của
A. CuS + dung dịch HCl loãng
B. FeS + dung dịch HCl loãng
C. FeS + dung dịch H2SO4 đặc, t o
D. S+ H2