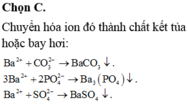Ion nào sau đây có nhiều electron nhất
A. SO42-. B. CO32-. C. NO3-. D. NH4+.

Những câu hỏi liên quan
Ion nào sau đây có 32 electron ?A.
SO
4
2
-
B.
CO
3
2
-
C.
NH
4
+
D.
NO
3
-
Đọc tiếp
Ion nào sau đây có 32 electron ?
A. SO 4 2 - B. CO 3 2 -
C. NH 4 + D. NO 3 -
Dung dịch X chứa các ion: Na+, NH4+, CO32-, PO43-, NO3-, SO42-. Dùng chất nào sau đây có thể loại bỏ được nhiều anion nhất? A. Ba(NO3)2 B. MgCl2 C. BaCl2 D. NaOH
Đọc tiếp
Dung dịch X chứa các ion: Na+, NH4+, CO32-, PO43-, NO3-, SO42-. Dùng chất nào sau đây có thể loại bỏ được nhiều anion nhất?
A. Ba(NO3)2
B. MgCl2
C. BaCl2
D. NaOH
Đáp án A
Dùng Ba(NO3)2 thì:
CO32-+ Ba2+ → BaCO3 ↓
2PO43- + 3Ba2+→ Ba3(PO4)2
SO42-+ Ba2+ → BaSO4
Khi đó trong dung dịch chỉ còn anion NO3-
Đúng 0
Bình luận (0)
Có bao nhiêu electron trong mỗi ion sau đây : NO3- , SO42- , CO32- ; Br , NH4+
NO3- có 6 e-
SO42- có 8e-
CO32- có 6e-
Br không có e
NH4+ có 4e-
Đúng 0
Bình luận (1)
Khí hiệu E là số e chứa trong 1 nguyên tử.
- NO3- nghĩa là NO3 nhận thêm 1e
=> số e = EN + 3EO + 1 = 7+3*8+1= 32
- NH4+ là NH4 mất đi 1e
=> số e = EN + 4EH -1 = 7 + 4 - 1 = 10
Các ý còn lại e làm tương tự nhé
Đúng 0
Bình luận (0)
Cho dung dịch có chứa các ion:
N
a
+
,
N
H
4
+
,
C
O
3
2
-
,
P
O
4
3
-
,
N...
Đọc tiếp
Cho dung dịch có chứa các ion: N a + , N H 4 + , C O 3 2 - , P O 4 3 - , N O 3 - , S O 4 2 - . Dùng hóa chất nào để loại được nhiều anion nhất?
A. BaCl2
B. MgCl2.
C. Ba(NO3)2.
D. NaOH.
Cho dung dịch chứa các anion: Na+, NH4+, CO32-, PO43-, NO3-, SO42-. Dùng chất nào sau đây có thể loại bỏ được nhiều anion nhất? A. KCl B. Ba(NO3)2 C. NaOH D. HCl
Đọc tiếp
Cho dung dịch chứa các anion: Na+, NH4+, CO32-, PO43-, NO3-, SO42-. Dùng chất nào sau đây có thể loại bỏ được nhiều anion nhất?
A. KCl
B. Ba(NO3)2
C. NaOH
D. HCl
Có 2 dung dịch chứa 2 cation và 2 anion không trùng nhau trong các ion sau: K+ (0,15 mol), Mg2+ (0,1 mol), NH4+ (0,25 mol), H+ (0,25 mol), Cl- (0,1 mol), SO42- (0,075 mol), NO3- (0,25 mol), CO32- (0,15 mol). Một trong 2 dung dịch trên chứa các ion nào dưới đây? A. K+, Mg2+, SO42-, Cl- B. K+, NH4+, CO32-, Cl- C. NH4+, H+, NO3-, SO42- D. Mg2+, H+, SO42-, Cl-
Đọc tiếp
Có 2 dung dịch chứa 2 cation và 2 anion không trùng nhau trong các ion sau: K+ (0,15 mol), Mg2+ (0,1 mol), NH4+ (0,25 mol), H+ (0,25 mol), Cl- (0,1 mol), SO42- (0,075 mol), NO3- (0,25 mol), CO32- (0,15 mol). Một trong 2 dung dịch trên chứa các ion nào dưới đây?
A. K+, Mg2+, SO42-, Cl-
B. K+, NH4+, CO32-, Cl-
C. NH4+, H+, NO3-, SO42-
D. Mg2+, H+, SO42-, Cl-
Đáp án B
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn được thỏa mãn. Ở đây chỉ có đáp án B thỏa mãn.
Đúng 0
Bình luận (0)
Xác định số oxi hóa của Mn, Cr, Cl, P, N, S, C, Br:
Trong ion: NO3-, SO42-, CO32-, Br-, NH4+.
Trong ion:
NO3-: x + 3.(-2) = -1 ⇒ x = 5 ⇒ N có số oxi hóa là +5 trong hợp chất NO3-.
SO42-: x + 4.(-2) = -2 ⇒ x = 6 ⇒ S có số oxi hóa là +6.
CO32-: x + 3.(-2) = -2 ⇒ x = 4 ⇒ C có số oxi hóa là +4.
Br-: Br có số oxi hóa là -1
NH4+: x + 4 = 1 ⇒ x = -3 ⇒ N có số oxi hóa là -3.
Đúng 0
Bình luận (0)
Xác định số oxi hóa của Mn, Cr, Cl, P, N, S, C, Br:
a. Trong phân tử: KMnO4, Na2Cr2O7, KClO3, H3PO4.
b. Trong ion: NO3-, SO42-, CO32-, Br-, NH4+.
a) Số oxi hóa của Mn trong $KMnO_4$ là $+7$
Số oxi hóa của Cr trong $Na_2Cr_2O_7$ là $+6$
Số oxi hóa của $Cl$ trong $KClO_3$ là $+5$
Số oxi hóa của $P$ trong $H_3PO_4$ là $+5$
b)
Số oxi hóa của $N$ trong $NO_3^-$ là $+5$
Số oxi hóa của $S$ trong $SO_4^{2-}$ là $+6$
Số oxi hóa của $C$ trong $CO_3^{2-}$ là $+4$
Số oxi hóa của $Br$ trong $Br^-$ là $-1$
Số oxi hóa của $N$ trong $NH_4^+$ là $-3$
Đúng 3
Bình luận (0)
Số electron trong các ion sau: NO3-, NH4+ , HCO3-, H+ , SO42- theo thứ tự là A. 32, 12, 32, 1, 50. B. 31, 11, 31, 2, 48. C. 32, 10, 32, 2, 46. D. 32, 10, 32, 0, 50.
Đọc tiếp
Số electron trong các ion sau: NO3-, NH4+ , HCO3-, H+ , SO42- theo thứ tự là
A. 32, 12, 32, 1, 50.
B. 31, 11, 31, 2, 48.
C. 32, 10, 32, 2, 46.
D. 32, 10, 32, 0, 50.
Đáp án D.
Số hạt e trong các nguyên tử N (e = 7), H (e = 1), O (e = 8), S (e = 16), C( e = 6).
Phân tử NO3-: số e = eN + eO.3 + 1 =32 do NO3- đã nhận thêm 1e
Phân tử NH4+: số e = eN + eH .4 -1 = 10 do NH4+ đã nhường đi 1 e
Phân tử HCO3-: số e = eH + eC + eO.3 + 1 = 32
Phân tử H+: số e = 0
Phân tử SO42-: eS + eO.4 + 2 = 50
Đúng 0
Bình luận (0)