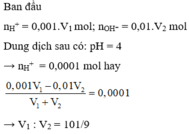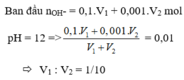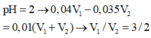Những câu hỏi liên quan
Trộn
V
1
lít dung dịch
H
2
SO
4
có pH 3 với
V
2
lít dung dịch NaOH có pH 12, thu được dung dịch mới có pH 4. Tỉ số
V
1
:
V
2
có giá trị là A. 8/1 B. 101/9 C. 10/1 D. 4/1
Đọc tiếp
Trộn V 1 lít dung dịch H 2 SO 4 có pH = 3 với V 2 lít dung dịch NaOH có pH = 12, thu được dung dịch mới có pH = 4. Tỉ số V 1 : V 2 có giá trị là
A. 8/1
B. 101/9
C. 10/1
D. 4/1
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M thu được V1+ V2 lít dung dịch có pH 2. Xác định tỉ lệ V1/V2 : A. 3/2 B. 2/3 C. 2 D. 1
Đọc tiếp
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M thu được V1+ V2 lít dung dịch có pH = 2. Xác định tỉ lệ V1/V2 :
A. 3/2
B. 2/3
C. 2
D. 1
Đáp án A
nH+ = 0,04V1 (mol); nOH-= 0,035V2 (mol)
H++ OH- → H2O
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,04V1- 0,035V2
[H+]dư = nH+ dư/ Vdd = (0,04V1- 0,035V2)/(V1+ V2) = 10-2
Suy ra V1/V2 = 3/2
Đúng 0
Bình luận (0)
Trộn
V
1
lít dung dịch
H
2
S
O
4
0,02M với
V
2
lít dung dịch NaOH 0,035M ta thu được
V
1
+
V
2
lít dung dịch có pH 2. Xác định tỉ lệ
V
1
/
V
2
A. 2...
Đọc tiếp
Trộn V 1 lít dung dịch H 2 S O 4 0,02M với V 2 lít dung dịch NaOH 0,035M ta thu được V 1 + V 2 lít dung dịch có pH = 2. Xác định tỉ lệ V 1 / V 2
A. 2
B. 3/2
C. 2/3
D. 1
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M ta thu được V1 + V2 lít dung dịch có pH 2. Xác định tỉ lệ V1/V2 A. 2 B. 3/2 C. 2/3 D. 1
Đọc tiếp
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M ta thu được V1 + V2 lít dung dịch có pH = 2. Xác định tỉ lệ V1/V2
A. 2
B. 3/2
C. 2/3
D. 1
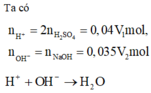
Để thu được dung dịch có pH = 2 chứng tỏ dung dịch sau phản ứng chứa axit dư [H+] dư = 0,01 M
→ nH+(du) = 0,04V1-0,035V2 = 0,01.(V1 + V2) → 0,03V1 = 0,045V2 → V1 : V2 = 3:2
Đáp án B
Đúng 0
Bình luận (0)
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M ta thu được V1 + V2 lít dung dịch có pH = 2. Xác định tỉ lệ V1/V2
A. 2
B. 3/2
C. 2/3
D. 1
Trộn
V
1
ml dung dịch NaOH có pH 13 với
V
2
ml dung dịch
Ba
OH
2
có pH 11, thu được dung dịch mới có pH 12. Tỉ số
V
1
:
V
2
có giá trị là A. 1/1 B. 2/1 C. 1/10 D. 10/1
Đọc tiếp
Trộn V 1 ml dung dịch NaOH có pH = 13 với V 2 ml dung dịch Ba OH 2 có pH = 11, thu được dung dịch mới có pH = 12. Tỉ số V 1 : V 2 có giá trị là
A. 1/1
B. 2/1
C. 1/10
D. 10/1
Biết rằng A là dung dịch NaOH có pH 12 và B là dung dịch H2SO4 có pH 2. Để V1 lít dung dịch A trung hòa với V2 lít dung dịch B thì tỉ lệ V1 : V2 là A. V1 V2 B. V1 2V2 C. V2 2V1 D. V2 10 V1
Đọc tiếp
Biết rằng A là dung dịch NaOH có pH = 12 và B là dung dịch H2SO4 có pH = 2. Để V1 lít dung dịch A trung hòa với V2 lít dung dịch B thì tỉ lệ V1 : V2 là
A. V1 = V2
B. V1 = 2V2
C. V2 = 2V1
D. V2 = 10 V1
Biết rằng A là dung dịch NaOH có pH 12 và B là dung dịch H2SO4 có pH 2. Để V1 lít dung dịch A trung hòa với V2 lít dung dịch B thì tỉ lệ V1 : V2 là A. V1 V2 B. V1 2V2 C. V2 2V1 D. V2 10V1
Đọc tiếp
Biết rằng A là dung dịch NaOH có pH = 12 và B là dung dịch H2SO4 có pH = 2. Để V1 lít dung dịch A trung hòa với V2 lít dung dịch B thì tỉ lệ V1 : V2 là
A. V1 = V2
B. V1 = 2V2
C. V2 = 2V1
D. V2 = 10V1
X là dung dịch H2SO4 0,02M, Y là dung dịch NaOH 0,035M. Khi trộn V1 lít dung dịch X với V2 lít dung dịch Y thu được dung dịch Z có pH = 2. Tỷ lệ V1/V2 là
A. 3/2
B. 2/3
C. 1/2
D. 2