Cân bằng phương trình phản ứng sau theo phương pháp thằng bằng e
FeS2 + O2 -----t---> Fe2O3 +SO2
Cho phản ứng hóa học sau: F e S 2 + O 2 → F e 2 O 3 + S O 2
Khi cân bằng phương trình phản ứng với hệ số các chất là các số nguyên tối giản, hệ số của O2 là
A. 4
B. 6
C. 9
D. 11
Chọn D
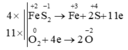
4 F e S 2 + 11 O 2 → 2 F e 2 O 3 + 8 S O 2
Câu 1: Đốt cháy pirit sắt FeS2 trong khí oxi, phản ứng xảy ra theo phương trình: FeS2 + O2 -> Fe2O3 + SO2 Sau khi cân bằng hệ số của các chất là phương án nào sau đây?
A. 2, 3, 2, 4 B. 4, 11, 2, 8 C. 4, 12, 2, 6 D. 4, 10, 3, 7
Câu 2: Cho 6,5g Zn tác dụng với dung dịch có chứa 12g HCl. Thể tích khí H2
( đktc) thu được là:
A. 1,12lít B. 2,24 lít C.3,36 lít D. 2,42 lít
Câu 3: Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2 -> Cu + H2O
B. Mg +2HCl -> MgCl2 +H2
C. Ca(OH)2 + CO2 -> CaCO3 +H2O
D. Zn + CuSO4 ->ZnSO4 +Cu
Câu 4: Trong số các chất có công thức hoá học dưới đây, chất nào làm quì tím hoá đỏ:
A. H2O B. HCl C. NaOH D. Cu
Câu 5: Thể tích khí hiđro thoát ra (đktc) khi cho 9,8g kẽm tác dụng với 9,8g Axit sunfuric là:
A. 22,4 lít B. 44,8 lít C. 4,48 lít D. 2,24 lít
Câu 6: Các câu sau, câu nào đúng khi định nghĩa dung dịch?
A. Dung dịch là hỗn hợp đồng nhất của chất rắn và chất lỏng
B. Dung dịch là hỗn hợp đồng nhất của chất khí và chất lỏng
C. Dung dịch là hỗn hợp đồng nhất của hai chất lỏng
D. Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi
Câu 7: Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
A. Tăng B. Giảm C. Có thể tăng hoặc giảm D. Không thay đổi
Câu 8: Dãy chất nào chỉ toàn bao gồm axit:
A. HCl; NaOH B. CaO; H2SO4 C. H3PO4; HNO3 D. SO2; KOH
Câu 9: Dãy chất nào chỉ toàn bao gồm muối:
A. MgCl; Na2SO4; KNO3
B. Na2CO3; H2SO4; Ba(OH)2
C. CaSO4; HCl; MgCO3
D. H2O; Na3PO4; KOH
Câu 10: Cho biết phát biểu nào dưới đây là đúng:
A. Gốc sunfat SO4 hoá trị I B. Gốc photphat PO4 hoá trị II
C. Gốc Nitrat NO3 hoá trị III D. Nhóm hiđroxit OH hoá trị I
Câu 11: Ở 200C hoà tan 40g KNO3 vào trong 95g nước thì được dung dịch bão hoà. Độ tan của KNO3 ở nhiệt độ 200C là:
A. 40,1g B. 44, 2g C. 42,1g D. 43,5g
Câu 12: Câu nào đúng khi nói về nồng độ phần trăm?
Nồng độ phần trăm là nồng độ cho biết:
A.Số gam chất tan có trong 100g dung dịch
B. Số gam chất tan có trong 100g dung dịch bão hoà
C. Số gam chất tan có trong 100g nước
D. Số gam chất tan có trong 1 lít dung dịch
Câu 13: Hoà tan 12g SO3 vào nước để được 100ml dung dịch.Nồng độ của dung dịch H2SO4 thu được là:
A. 1,4M B. 1,5M C. 1,6M D, 1,7M
Câu 14: Trộn 2 lít dung dịch HCl 4M vào 1 lít dung dịch HCl 0,5M. Nồng độ mol của dung dịch mới là:
A. 2,82M B. 2,81M C. 2,83M D. Tất cả đều sai
Câu 15: Ở 200C, độ tan của dung dịch muối ăn là 36g. Nồng độ % của dung dịch muối ăn bão hoà ở 200C là:
A. 25% B. 22,32% C. 26,4% D. 25,47%
Câu 16: Hợp chất nào sau đây là bazơ:
A. Đồng(II) nitrat B. Kali clorua C. Sắt(II) sunfat D. Canxi hiđroxit
Câu 17: Cặp chất nào sau đây khi tan trong nước chúng tác dụng với nhau tạo ra chất kết tủa?
A. NaCl và AgNO3 B. NaOH và HCl C. KOH và NaCl D. CuSO4 và HCl
Câu 18: Hoà tan 124g Na2O vào 876ml nước, phản ứng tạo ra NaOH. Nồng độ phần trăm của dung dịch thu được là
A. 16% B. 17% C. 18% D.19%
Câu 19: Nồng độ mol/lít của dung dịch là:
A. Số gam chất tan trong 1 lít dung dịch
B. Số gam chất tan trong 1lít dung môi
C. Số mol chất tan trong 1lít dung dịch
D. Số mol chất tan trong 1lít dung môi
Câu 20: Tất cả các kim loại trong dãy nào sau đây tác dụng được với H2O ở nhiệt độ thường?
A. Fe, Zn, Li, Sn B. Cu, Pb, Rb, Ag
C. K, Na, Ca, Ba D. Al, Hg, Cs, Sr
Câu 1: Đốt cháy pirit sắt FeS2 trong khí oxi, phản ứng xảy ra theo phương trình: FeS2 + O2 -> Fe2O3 + SO2 Sau khi cân bằng hệ số của các chất là phương án nào sau đây?
A. 2, 3, 2, 4 B. 4, 11, 2, 8 C. 4, 12, 2, 6 D. 4, 10, 3, 7
Câu 2: Cho 6,5g Zn tác dụng với dung dịch có chứa 12g HCl. Thể tích khí H2
( đktc) thu được là:
A. 1,12lít B. 2,24 lít C.3,36 lít D. 2,42 lít
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=0,1\left(mol\right);n_{HCl}=0,33\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,1}{1}< \dfrac{0,33}{2}\) => HCl dư
\(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=2,24\left(l\right)\)
Câu 3: Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2 -> Cu + H2O
B. Mg +2HCl -> MgCl2 +H2
C. Ca(OH)2 + CO2 -> CaCO3 +H2O
D. Zn + CuSO4 ->ZnSO4 +Cu
Câu 4: Trong số các chất có công thức hoá học dưới đây, chất nào làm quì tím hoá đỏ:
A. H2O B. HCl C. NaOH D. Cu
Câu 5: Thể tích khí hiđro thoát ra (đktc) khi cho 9,8g kẽm tác dụng với 9,8g Axit sunfuric là:
A. 22,4 lít B. 44,8 lít C. 4,48 lít D. 2,24 lít
\(n_{Zn}=0,15\left(mol\right);n_{H_2SO_4}=0,1\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Lập tỉ lệ : \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\) => Zn dư
\(n_{H_2}=n_{H_2SO_4}=0,1\left(mol\right)\Rightarrow V_{H_2}=2,24\left(l\right)\)
Câu 6: Các câu sau, câu nào đúng khi định nghĩa dung dịch?
A. Dung dịch là hỗn hợp đồng nhất của chất rắn và chất lỏng
B. Dung dịch là hỗn hợp đồng nhất của chất khí và chất lỏng
C. Dung dịch là hỗn hợp đồng nhất của hai chất lỏng
D. Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi
Câu 7: Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
A. Tăng B. Giảm C. Có thể tăng hoặc giảm D. Không thay đổi
Câu 8: Dãy chất nào chỉ toàn bao gồm axit:
A. HCl; NaOH B. CaO; H2SO4 C. H3PO4; HNO3 D. SO2; KOH
Câu 9: Dãy chất nào chỉ toàn bao gồm muối:
A. MgCl2; Na2SO4; KNO3
B. Na2CO3; H2SO4; Ba(OH)2
C. CaSO4; HCl; MgCO3
D. H2O; Na3PO4; KOH
Câu 10: Cho biết phát biểu nào dưới đây là đúng:
A. Gốc sunfat SO4 hoá trị I B. Gốc photphat PO4 hoá trị II
C. Gốc Nitrat NO3 hoá trị III D. Nhóm hiđroxit OH hoá trị I
Câu 11: Ở 200C hoà tan 40g KNO3 vào trong 95g nước thì được dung dịch bão hoà. Độ tan của KNO3 ở nhiệt độ 200C là:
A. 40,1g B. 44, 2g C. 42,1g D. 43,5g
40 gam KNO3 hòa tan trong 95 gam nước
? gam KNO3 hòa tan trong 100 gam nước
Vậy độ tan có giá trị là: \(\dfrac{40.100}{95}=42,11\)
Câu 12: Câu nào đúng khi nói về nồng độ phần trăm?
Nồng độ phần trăm là nồng độ cho biết:
A.Số gam chất tan có trong 100g dung dịch
B. Số gam chất tan có trong 100g dung dịch bão hoà
C. Số gam chất tan có trong 100g nước
D. Số gam chất tan có trong 1 lít dung dịch
Câu 13: Hoà tan 12g SO3 vào nước để được 100ml dung dịch.Nồng độ của dung dịch H2SO4 thu được là:
A. 1,4M B. 1,5M C. 1,6M D, 1,7M
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{SO_3}=\dfrac{12}{80}=0,15\left(mol\right)=n_{H_2SO_4}\)
=> \(CM_{H2SO4}=\dfrac{0,15}{0,1}=1,5M\)
Câu 14: Trộn 2 lít dung dịch HCl 4M vào 1 lít dung dịch HCl 0,5M. Nồng độ mol của dung dịch mới là:
A. 2,82M B. 2,81M C. 2,83M D. Tất cả đều sai
\(CM_{HCl}=\dfrac{2.4+1.0,5}{2+1}=2,83M\)
Câu 15: Ở 200C, độ tan của dung dịch muối ăn là 36g. Nồng độ % của dung dịch muối ăn bão hoà ở 200C là:
A. 25% B. 22,32% C. 26,4% D. 25,47%
Độ tan của NaCl là 36g
=> 100g H2O hòa tan trong 36g NaCl
=> mdd = 100+ 36 = 136g
\(C\%=\dfrac{36}{136}.100=26,47\%\)
Câu 16: Hợp chất nào sau đây là bazơ:
A. Đồng(II) nitrat B. Kali clorua C. Sắt(II) sunfat D. Canxi hiđroxit
Câu 17: Cặp chất nào sau đây khi tan trong nước chúng tác dụng với nhau tạo ra chất kết tủa?
A. NaCl và AgNO3 B. NaOH và HCl C. KOH và NaCl D. CuSO4 và HCl
\(NaCl+AgNO_3\rightarrow AgCl+NaNO_3\)
Câu 18: Hoà tan 124g Na2O vào 876ml nước, phản ứng tạo ra NaOH. Nồng độ phần trăm của dung dịch thu được là
A. 16% B. 17% C. 18% D.19%
\(Na_2O+H_2O\rightarrow2NaOH\)
\(n_{NaOH}=2n_{Na_2O}=2.\dfrac{124}{62}=4\left(mol\right)\)
=> \(C\%_{NaOH}=\dfrac{4.40}{124+876}.100=16\%\)
Câu 19: Nồng độ mol/lít của dung dịch là:
A. Số gam chất tan trong 1 lít dung dịch
B. Số gam chất tan trong 1lít dung môi
C. Số mol chất tan trong 1lít dung dịch
D. Số mol chất tan trong 1lít dung môi
Câu 20: Tất cả các kim loại trong dãy nào sau đây tác dụng được với H2O ở nhiệt độ thường?
A. Fe, Zn, Li, Sn B. Cu, Pb, Rb, Ag
C. K, Na, Ca, Ba D. Al, Hg, Cs, Sr
Cân bằng các phương trình phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
a) Al + Fe3O4 → Al2O3 + Fe
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
c) FeS2 + O2 → Fe2O3 + SO3
d) KClO3 → KCl + O2
e) Cl2 +KOH → KCl + KClO3 + H2O
Cân bằng các phương trình phản ứng oxi hóa – khử:
![]()
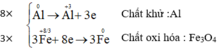
![]()
![]()

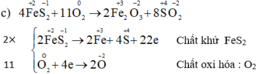

Cân bằng phương trình :FeS2 + O2----> Fe2O3 + SO2
Câu 12: Đốt cháy quặng pirit sắt(FeS2) thu được sắt (III) oxit Fe2O3 và khí sunfuarơ SO2. Phương trình phản ứng nào sau đây đã viết đúng?
A. FeS2+ O2-> Fe2O3 + SO2 B. FeS2 + O2 -> Fe2O3 + 2SO2
C. 2FeS2+ O2-> Fe2O3 + SO2 D. 4FeS2 +11 O2 ->2 Fe2O3 + 8SO2
4FeS2 + 11O2 \(\underrightarrow{t^o}\) 2Fe2O3 + 8SO2
=> Đáp án D
\(D. 4FeS_2 +11 O_2 ->2 Fe_2O3 + 8SO_2 \)
Câu 12: Đốt cháy quặng pirit sắt(FeS2) thu được sắt (III) oxit Fe2O3 và khí sunfuarơ SO2. Phương trình phản ứng nào sau đây đã viết đúng?
A. FeS2+ O2-> Fe2O3 + SO2 B. FeS2 + O2 -> Fe2O3 + 2SO2
C. 2FeS2+ O2-> Fe2O3 + SO2 D. 4FeS2 +11 O2 ->2 Fe2O3 + 8SO2
Cân bằng phương trình hoá học các phương oxi hóa khử sau bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa trong mỗi phản ứng đó:
a) NH3 + O2 --> NO + H2O
b) H2S + O2 --> S + H2O
c) Al + Fe2O3 --> Al2O3 + Fe
d) CO + Fe2O3 --> Fe + CO2
e) CuO + CO --> Cu + CO2
a) 4NH3 + 5O2 -to-> 4NO + 6H2O
Chất khử: NH3, chất oxh: O2
| \(N^{-3}-5e->N^{+2}\) | x4 |
| \(O_2^0+4e->2O^{-2}\) | x5 |
b) 2H2S + O2 -to-> 2S + 2H2O
Chất khử: H2S, chất oxh: O2
| \(S^{-2}-2e->S^0\) | x2 |
| \(O^0_2+4e->2O^{-2}\) | x1 |
c) 2Al + Fe2O3 -to-> Al2O3 + 2Fe
Chất khử: Al, chất oxh: Fe2O3
| Al0-3e--> Al+3 | x2 |
| Fe2+3 +6e--> 2Fe0 | x1 |
d) Fe2O3 + 3CO -to-> 2Fe + 3CO2
Chất oxh: Fe2O3, chất khử: CO
| Fe2+3 +6e-->2Fe0 | x1 |
| C+2 - 2e --> C+4 | x3 |
e) CuO + CO -to-> Cu + CO2
Chất oxh: CuO, chất khử: CO
| Cu+2 +2e-->Cu0 | x1 |
| C+2 -2e --> C+4 | x1 |
Lập các phương trình phản ứng hóa học theo sơ đồ sau.
a C O + F e 2 O 3 → t ° F e + C O 2 b F e S 2 + O 2 → t ° F e 2 O 3 + S O 2 c ? + H C l → F e C l 2 + H 2 d A g N O 3 + ? → A l N O 3 2 + A g
Câu 1: Cân bằng các phản ứng sau theo phương pháp thăng bằng electron:
a) NH3 + O2 → NO + H2O
b) PH3 + O2 → P2O5 + H2O
c) SO2 + Br2 + H2O → H2SO4 + HBr
d) Fe + H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + H2O
e) Al + HNO3 → Al(NO3)3 + N2 + H2O.