Dung dịch X chứa các ion: 0,1 mol Na+ ; 0,2 mol Ca2+ ; 0,3 mol Mg2+ ; 0,4 mol Cl‒ và x mol HCO3–. Đun sôi dung dịch X thu được dung dịch Y. Dung dịch Y là
A. nước cứng toàn phần
B. nước cứng vĩnh cửu
C. nước mềm
D. nước cứng tạm thời
Dung dịch X chứa các ion: 0,1 mol Na+ ; 0,2 mol Ca2+ ; 0,3 mol Mg2+ ; 0,4 mol Cl‒ và x mol HCO3–. Đun sôi dung dịch X thu được dung dịch Y. Dung dịch Y là
A. nước cứng toàn phần
B. nước cứng vĩnh cửu
C. nước mềm
D. nước cứng tạm thời
Đáp án B
Bảo toàn điện tích: x=0,7 và x <0,2.2+0,3.2 do vậy đây là nước cứng vĩnh cửu
Một dung dịch có chứa các ion: Na+ (0,2 mol), Mg2+ (0,1 mol), Ca2+ (0,05 mol), NO3- (0,15 mol) và Cl- (x mol). Giá trị của x là
A. 0,35
B. 0,3
C. 0.15
D. 0,2
Chọn A
Bảo toàn điện tích ⇒ 0,2.1 + 0,1.2 + 0,05.2 = 0,15.1 + 1.x x = 0,35
Một dung dịch có chứa các ion: Na+ (0,2 mol), Mg2+ (0,1 mol), Ca2+ (0,05 mol), NO3- (0,15 mol) và Cl- (x mol). Giá trị của x là
A. 0,35.
B. 0,3.
C. 0.15.
D. 0,2.
Bảo toàn điện tích → 0,2.1 + 0,1.2 + 0,05.2 = 0,15.1 + 1.x → x = 0,35
Đáp án A
Dung dịch X chứa các ion: Ca2+, Na+, \(HCO_3^-\) và Cl-, trong đó số mol của ion Cl- là 0,1. Cho \(\dfrac{1}{2}\) dung dịch X phản ứng với dung dịch NaOH (dư), thu được 2g kết tủa. Cho \(\dfrac{1}{2}\) dung dịch X còn lại phản ứng với dung dịch \(Ca\left(OH\right)_2\)(dư), thu được 3 gam kết tủa. Mặt khác, nếu cô cạn dung dịch X thì thu được m gam chất rắn khan. Giá trị của m là
Thí nghiệm 2 :
$HCO_3^- + OH^- \to CO_3^{2-} + H_2O$
$Ca^{2+} + CO_3^{2-} \to CaCO_3$
$n_{HCO_3^-} = n_{CO_3^{2-}} = n_{CaCO_3} = \dfrac{3}{100} = 0,03(mol)$
Thí nghiệm 1 : $Ca^{2+}$ hết $CO_3^{2-}$ dư
$n_{Ca^{2+}} = n_{CaCO_3} = \dfrac{2}{100} = 0,02(mol)$
Vậy X gồm :
$Ca^{2+}(0,02\ mol) ; Na^+ ; HCO_3^-(0,03\ mol) ; Cl^-(0,1\ mol)$
Bảo toàn điện tích : $n_{Na^+} = 0,09(mol)$
Cô cạn thì $HCO_3^- \to CO_3^{2-} + CO_2 + H_2O$
$m = 0,02.40 + 0,09.23 + 0,03.60 + 0,1.35,5 = 8,22(gam)$
Một dung dịch Y có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol), và SO42- (x mol). Khối lượng chất tan có trong dung dịch Y là
Cho 200 ml dung dịch X chứa các ion NH4+ (0,5M), K+ (0,1M), SO42- (0,25M), Cl- (aM). Biết rằng dung dịch X được điều chế bằng cách hoà tan 2 muối vào nước. Khối lượng của 2 muối được lấy là
giải dùm mình cần gấp tối nay lúc 10h giúp dùm mình cần gấp
Một dung dịch có chứa các ion: NH 4 + (0,1 mol), K + (0,15 mol), NO 3 - (0,1 mol), và CO 3 2 - (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl 2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
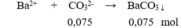
m↓ = 0,075.197 = 14,775 gam.
Dung dịch X có chứa 0,5 mol Na+; 0,2 mol Cl-; 0,1 mol NO3-; 0,1 mol Ca2+; 0,1 mol Mg2+;và HCO3-. Đun sôi dung dịch X đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Dung dịch Y là:
A. Nước mềm
B. nước có tính cứng tạm thời
C. nước có tính cứng vĩnh cửu
D. nước có tính cứng toàn phần
Dung địch X chứa 0,025 mol ; 0,1 mol Na+; 0,3 mol ; còn lại là ion . Cho 270 ml dung dịch Ba(OH)2 0,2M vào dung dịch X và đun nóng nhẹ. Hỏi tổng khối lượng dung dịch X và dung dịch Ba(OH)2 giảm bao nhiêu gam? Giả sử nước bay hơi không đáng kể.
A. 4,125
B. 5,269
C. 6,761
D. Đ/a khác
Đáp án C
Áp dụng định luật bảo toàn điện tích ta có:
![]()
Khối lượng dung dịch X giảm là do có khí NH3 thoát ra khỏi dung dịch và BaCCb kết tủa trong dung dịch sản phẩm:
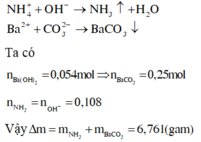
Câu1: Một dung dịch chứa 0,2 mol Cu2+; 0,1 mol K+; 0,05 mol Cl- và x mol SO42-. Tổng khối lượng muối có trong dung dịch là m gam. Giá trị của m Câu2: Trộn 150 ml dung dịch Na2SO4 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Na+ có trong dung dịch tạo thành Câu3: Giá trị pH của dung dịch HCl 0,1M Câu4: Trên chai hóa chất có ghi: dung dịch HCl 0,1M. Hỏi trong chai hóa chất đó chứa ion nào sau đây? (không kể sự điện li của H2O). Câu 5: Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x Câu 6: Cho m gam NaOH vào H2O để được 2 lít dung dịch NaOH có pH=12. Giá trị của m Câu 7: Trộn lẫn 250 ml dung dịch KOH 0,03M với 250 ml dung dịch HCl 0,01M được 500 ml dung dịch Y. Dung dịch Y có pH Câu 8:
Câu 3 :
\(pH=-log\left[H^+\right]=-log\left(0.1\right)=1\)
Câu 4 :
Chứa các ion : H+ , Cl-
Câu 5 :
\(n_{NaOH}=n_{HCl}=0.02\cdot0.1=0.002\left(mol\right)\)
\(\Rightarrow x=\dfrac{0.002}{0.01}=0.2\left(M\right)\)
Câu 1 :
Bảo toàn điện tích :
\(n_{SO_4^{2-}}=\dfrac{0.2\cdot2+0.1-0.05}{2}=0.225\left(mol\right)\)
\(m_{Muối}=0.2\cdot64+0.1\cdot39+0.05\cdot35.5+0.225\cdot96=40.075\left(g\right)\)
Câu 2 :
\(\left[Na^+\right]=\dfrac{0.15\cdot0.5\cdot2+0.05\cdot1}{0.15+0.05}=1\left(M\right)\)
Câu 6 :
\(pH=14+log\left[OH^-\right]=12\)
\(\Rightarrow\left[OH^-\right]=0.01\)
\(n_{NaOH}=n_{OH}=0.01\cdot2=0.02\left(mol\right)\)
\(\Rightarrow m_{NaOH\left(bđ\right)}=0.02\cdot40=0.8\left(g\right)\)
Câu 7 :
\(n_{KOH}=0.25\cdot0.03=0.0075\left(mol\right)\)
\(n_{HCl}=0.25\cdot0.01=0.0025\left(mol\right)\)
\(\Rightarrow n_{KOH\left(dư\right)}=0.0075-0.0025=0.005\left(mol\right)\)
\(\left[OH^-\right]=\dfrac{0.005}{0.25+0.25}=0.01\)
\(pH=14+log\left[OH^-\right]=14+log\left(0.01\right)=12\)