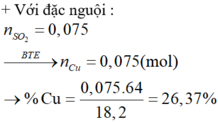Cho 19,32gam hỗn hợp A gồm Cu và kim loại M ( không có hóa trị I trong hợp chất) tác dụng với lượng dư dung dịch H2SO4 loãng, thu được 2,8 lit H2, dung dịch B và chất rắn D. Cho B tác dụng với lượng dư dung dịch NaOH, thu được kết tủa E, lọc lấy E đem nung đến khối lượng không đổi thì thu được m gam chất rắn. mặt khác cho 19,32 gam A tác dụng với lượng dư dung dịch H2SO4 đặc , đun nóng , thu được V lit khí SO2 ( sản phẩm khử duy nhất) . Hấp thụ toàn bộ V lít khí SO2 vào dung dịch nước vôi trong thì được 21,6 gam kết tủa và khối lượng dung dịch tăng 2,72 gam. Biết các phản ứng xảy ra hoàn toàn và các chất khí đều đo ở đktc. Tính giá trị V,m và xác định tên kim loại M

Những câu hỏi liên quan
Cho 18,2 gam hỗn hợp X gồm các kim loại Cr, Fe, Cu tác dụng với lượng dư dung dịch H2SO4 loãng, nóng (trong điều kiện không có không khí), thu được dung dịch Y, chất rắn Z và 5,6 lít khí H2 (ở đktc). Nếu cho 18,2 gam hỗn hợp X tác dụng với lượng dư dung dịch H2SO4 đặc, nguội thì thu được 1,68 lít khí SO2 (ở đktc). Thành phần % về khối lượng của crom và đồng trong hỗn hợp X là A. 42,86% và 26,37%. B. 48,21% và 9,23%. C. 42,86% va 48,21%. D. 48,21% và 42,56%.
Đọc tiếp
Cho 18,2 gam hỗn hợp X gồm các kim loại Cr, Fe, Cu tác dụng với lượng dư dung dịch H2SO4 loãng, nóng (trong điều kiện không có không khí), thu được dung dịch Y, chất rắn Z và 5,6 lít khí H2 (ở đktc). Nếu cho 18,2 gam hỗn hợp X tác dụng với lượng dư dung dịch H2SO4 đặc, nguội thì thu được 1,68 lít khí SO2 (ở đktc). Thành phần % về khối lượng của crom và đồng trong hỗn hợp X là
A. 42,86% và 26,37%.
B. 48,21% và 9,23%.
C. 42,86% va 48,21%.
D. 48,21% và 42,56%.
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A
Đúng 0
Bình luận (0)
Cho 18,2 gam hỗn hợp X gồm các kim loại Cr, Fe, Cu tác dụng với lượng dư dung dịch H2SO4 loãng, nóng (trong điều kiện không có không khí), thu được dung dịch Y, chất rắn Z và 5,6 lít khí H2 (ở đktc). Nếu cho 18,2 gam hỗn hợp X tác dụng với lượng dư dung dịch H2SO4 đặc, nguội thì thu được 1,68 lít khí SO2 (ở đktc). Thành phần % về khối lượng của crom và đồng trong hỗn hợp X là A. 42,86% và 26,37%. B. 48,21% và 9,23%. C. 42,86% va 48,21%. D. 48,21% và 42,56%.
Đọc tiếp
Cho 18,2 gam hỗn hợp X gồm các kim loại Cr, Fe, Cu tác dụng với lượng dư dung dịch H2SO4 loãng, nóng (trong điều kiện không có không khí), thu được dung dịch Y, chất rắn Z và 5,6 lít khí H2 (ở đktc). Nếu cho 18,2 gam hỗn hợp X tác dụng với lượng dư dung dịch H2SO4 đặc, nguội thì thu được 1,68 lít khí SO2 (ở đktc). Thành phần % về khối lượng của crom và đồng trong hỗn hợp X là
A. 42,86% và 26,37%.
B. 48,21% và 9,23%.
C. 42,86% va 48,21%.
D. 48,21% và 42,56%.
Chọn đáp án A
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%
Đúng 0
Bình luận (0)
Cho 12,8 gam hỗn hợp X gồm các kim loại Cr, Fe, Cu tác dụng với lượng dư dung dịch H2SO4 l loãng, nóng (trong điều kiện không có không khí), thu được dung dịch Y, Chất rắn Z và 5,6 lít khí H2 (ở đktc). Nếu cho 18,2 gam hỗn hợp X tác dụng với lượng dư dung dịch H2SO4 đặc, nguội thì thu được 1,68 lít khí SO2 (đktc). Thành phần % về khối lượng của crom và đồng trong hỗn hợp X là A. 42,86% và 26,37% B. 42,86% và 48,21% C. 48,21% và 42,56% D. 48,21% và 9,23%
Đọc tiếp
Cho 12,8 gam hỗn hợp X gồm các kim loại Cr, Fe, Cu tác dụng với lượng dư dung dịch H2SO4 l loãng, nóng (trong điều kiện không có không khí), thu được dung dịch Y, Chất rắn Z và 5,6 lít khí H2 (ở đktc). Nếu cho 18,2 gam hỗn hợp X tác dụng với lượng dư dung dịch H2SO4 đặc, nguội thì thu được 1,68 lít khí SO2 (đktc). Thành phần % về khối lượng của crom và đồng trong hỗn hợp X là
A. 42,86% và 26,37%
B. 42,86% và 48,21%
C. 48,21% và 42,56%
D. 48,21% và 9,23%
Cho hỗn hợp gồm Zn và Fe tác dụng với dung dịch chứa AgNO3 và Cu(NO3)2 thu được dung dịch A gồm 2 chất tan và chất rắn B gồm 3 kim loại. Cho B tác dụng với dung dịch H2SO4 loãng dư thấy có khí bay lên. Cho dung dịch A tác dụng với dung dịch Ba(OH)2 lấy dư thu được kết tủa C. Nung kết tủa C trong không khí đến khối lượng không đổi thu được chất rắn D. Xác định thành phần A, B, C, D và viết các PTHH xảy ra (biết các phản ứng xảy ra hoàn toàn) ?
Đọc tiếp
Cho hỗn hợp gồm Zn và Fe tác dụng với dung dịch chứa AgNO3 và Cu(NO3)2 thu được dung dịch A gồm 2 chất tan và chất rắn B gồm 3 kim loại. Cho B tác dụng với dung dịch H2SO4 loãng dư thấy có khí bay lên. Cho dung dịch A tác dụng với dung dịch Ba(OH)2 lấy dư thu được kết tủa C. Nung kết tủa C trong không khí đến khối lượng không đổi thu được chất rắn D. Xác định thành phần A, B, C, D và viết các PTHH xảy ra (biết các phản ứng xảy ra hoàn toàn) ?
Hỗn hợp X gồm Al2O3, Fe2O3, MgO, Cu. Cho X tác dụng với dung dịch NaOH dư, thu được dung dịch Y và chất rắn Z. Cho Y tác dụng với lượng dư dung dịch H2SO4 loãng, thu được dung dịch A. Cho A tác dụng với Z thu được dung dịch B làm quì tím hóa đỏ và chất rắn C. Cho B tác dụng với lượng dư H2SO4 đặc, nóng thu được dung dịch D và khí E. Xác định Y, Z, A, B, D, E và viết phương trình hóa học xảy ra.
Đọc tiếp
Hỗn hợp X gồm Al2O3, Fe2O3, MgO, Cu. Cho X tác dụng với dung dịch NaOH dư, thu được dung dịch Y và chất rắn Z. Cho Y tác dụng với lượng dư dung dịch H2SO4 loãng, thu được dung dịch A. Cho A tác dụng với Z thu được dung dịch B làm quì tím hóa đỏ và chất rắn C. Cho B tác dụng với lượng dư H2SO4 đặc, nóng thu được dung dịch D và khí E. Xác định Y, Z, A, B, D, E và viết phương trình hóa học xảy ra.
Hỗn hợp X gồm Al2O3, Fe2O3, MgO, Cu. Cho X tác dụng với dung dịch NaOH dư, thu được dung dịch Y và chất rắn Z. Cho Y tác dụng với lượng dư dung dịch H2SO4 loãng, thu được dung dịch A. Cho A tác dụng với Z thu được dung dịch B làm quỳ tím hóa đỏ và chất rắn C. Cho B tác dụng với lượng dư H2SO4 đặc, nóng thu được dung dịch D và khí E. Xác định Y,Z,A,B,D,E và viết phương trình hóa học xảy ra.
Đọc tiếp
Hỗn hợp X gồm Al2O3, Fe2O3, MgO, Cu. Cho X tác dụng với dung dịch NaOH dư, thu được dung dịch Y và chất rắn Z. Cho Y tác dụng với lượng dư dung dịch H2SO4 loãng, thu được dung dịch A. Cho A tác dụng với Z thu được dung dịch B làm quỳ tím hóa đỏ và chất rắn C. Cho B tác dụng với lượng dư H2SO4 đặc, nóng thu được dung dịch D và khí E. Xác định Y,Z,A,B,D,E và viết phương trình hóa học xảy ra.
\(X+NaOH:\\ Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\\ \Rightarrow Y:NaAlO_2,Z:Fe_2O_3,MgO,Cu\\ Y+H_2SO_4:\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ 2NaAlO_2+H_2SO_4+2H_2O\rightarrow2Al\left(OH\right)_3+Na_2SO_4\\ 2Al\left(OH\right)_3+3H_2SO_4\rightarrow Al_2\left(SO_{\text{4 }}\right)_3+6H_2O\\ \Rightarrow A:Na_2SO_4,Al_2\left(SO_4\right)_3,H_2SO_4\\ A+Z:\\ H_2SO_4+MgO\rightarrow MgSO_4+H_2O\\ Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ Cu+Fe_2\left(SO_4\right)_3\rightarrow CuSO_4+2FeSO_4\\ \Rightarrow B:MgSO_4,Na_2SO_4,CuSO_4,FeSO_4,Al_2\left(SO_4\right)_3,H_2SO_4;C:Cu\\ B+H_2SO_{4\left(đặc\right)}\\ 2FeSO_4+2H_2SO_{4\left(đặc\right)}→Fe_2(SO_4)_3+SO_2↑+2H_2O\\ \Rightarrow D:MgSO_4,Na_2SO_4,CuSO_4,Fe_2\left(SO_4\right)_3,Al_2\left(SO_4\right)_3,H_2SO_4\\ E:SO_2\)
Đúng 2
Bình luận (0)
Cho 10.8 gam hỗn hợp A gồm Cu và kim loại M (khối lượng của M lớn hơn khối lượng của Cu) tác dụng với dung dịch HCl dư, thu dược 2,912 lít khí (đktc). Nếu cho hỗn hợp A này tác dụng hết với dung dịch H2SO4 đặc, đun nóng thì thu được 5,6 lít khí SO2 (sản phẩm khử duy nhất, đktc). Mặt khác, nếu cho 5,4 gam hỗn hợp A tác dụng với 160 ml AgNO3 1M thu được m gam chắt rắn. Biết các phản ứng xảy ra hoàn toàn, kim loại M không có hóa trị (I) trong các hợp chất. Xác định giá trị m
Đọc tiếp
Cho 10.8 gam hỗn hợp A gồm Cu và kim loại M (khối lượng của M lớn hơn khối lượng của Cu) tác dụng với dung dịch HCl dư, thu dược 2,912 lít khí (đktc). Nếu cho hỗn hợp A này tác dụng hết với dung dịch H2SO4 đặc, đun nóng thì thu được 5,6 lít khí SO2 (sản phẩm khử duy nhất, đktc). Mặt khác, nếu cho 5,4 gam hỗn hợp A tác dụng với 160 ml AgNO3 1M thu được m gam chắt rắn. Biết các phản ứng xảy ra hoàn toàn, kim loại M không có hóa trị (I) trong các hợp chất. Xác định giá trị m
nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g
Đúng 1
Bình luận (0)
Cho 18,2 gam hỗn hợp các kim loại Fe, Cr, Cu tác dụng với lượng dư dung dịch
H
2
SO
4
loãng, nóng trong điều kiện không có không khí thu được dd Y và chất rắn Z cùng 5,6 lít
H
2
(đktc). Nếu cho 18,2 gam X tác dụng với lượng dư dd
H
2
SO
4
đặc, nguội thu được 1,68 lít khí
SO
2...
Đọc tiếp
Cho 18,2 gam hỗn hợp các kim loại Fe, Cr, Cu tác dụng với lượng dư dung dịch H 2 SO 4 loãng, nóng trong điều kiện không có không khí thu được dd Y và chất rắn Z cùng 5,6 lít H 2 (đktc). Nếu cho 18,2 gam X tác dụng với lượng dư dd H 2 SO 4 đặc, nguội thu được 1,68 lít khí SO 2 (đktc). Tính thành phần phần trăm crom trong hỗn hợp?
A. 42,86%
B. 52%
C. 26,37%
D. 43%.
Cho 9,2 gam hỗn hợp X gồm Mg, Fe và Cu tác dụng với 130ml dung dịch hỗn hợp Cu(NO3)2 1M, thu được 12,48 gam chất rắn Y và dung dịch Z. Cho toàn bộ chất rắn Y tác dụng với lượng dư dung dịch HCl, thu được 0,896 lít H2 (đktc). Cho dung dịch Z tác dụng với NaOH dư, lọc kết tủa, nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là: A. 7,12gam B. 7,60 gam C. 8,00 gam D. 10,80 gam
Đọc tiếp
Cho 9,2 gam hỗn hợp X gồm Mg, Fe và Cu tác dụng với 130ml dung dịch hỗn hợp Cu(NO3)2 1M, thu được 12,48 gam chất rắn Y và dung dịch Z. Cho toàn bộ chất rắn Y tác dụng với lượng dư dung dịch HCl, thu được 0,896 lít H2 (đktc). Cho dung dịch Z tác dụng với NaOH dư, lọc kết tủa, nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là:
A. 7,12gam
B. 7,60 gam
C. 8,00 gam
D. 10,80 gam