Thành phần chính của quặng đô – lô – mít là
A. C a C O 3 . M g C O 3 .
B. C a C O 3 . B a C O 3 .
C. C a C O 3 . C a S i O 3 .
D. B a C O 3 . M g C O 3 .
Thành phần chính của quặng đô – lô – mít là
A. C a C O 3 . M g C O 3 .
B. C a C O 3 . B a C O 3 .
C. C a C O 3 . C a S i O 3 .
D. B a C O 3 . M g C O 3 .
Chọn các chất A, B, C, D thích hợp và hoàn thành chuỗi phản ứng bằng phương trình hóa học (ghi điều kiện của phản ứng nếu có). Biết A là thành phần chính của quặng pirit sắt.
A → ( 1 ) B → ( 2 ) C → ( 3 ) D → ( 4 ) Fe → ( 5 ) FeCl 2 → ( 6 ) Fe ( NO 3 ) 2 Fe ( NO 3 ) 3
(1) 2FeS2 + 14H2SO4 đặc → Fe2(SO4)3 + 15SO2↑ + 14H2O
(2) Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
(3) 2Fe(OH)3 → Fe2O3 + 3H2O
(4) Fe2O3 + 3H2 → 2Fe + 3H2O
(5) Fe + 2HCl → FeCl2 + H2↑
(6) FeCl2 + 2AgNO3 → Fe(NO3)3 + 2AgCl↓
(7) Fe(NO3)2 + 2HNO3 → Fe(NO3)3 + NO2↑ + H2O
(8) Fe(NO3)3 + Fe → Fe(NO3)2
Thành phần trăm của nguyên tố nhôm trong quặng bôxit nhôm có thành phần chính là (Al2O3) là:
A. 52,91% B. 62,91 % C. 50,91 % D. 51,91 %
\(M_{Al_2O_3}=27\cdot2+16\cdot3=102\left(g/mol\right)\)
\(\%m_{Al}=\dfrac{27\cdot2\cdot100}{102}\approx52,91\%\\ =>A\)
1. A là 1 loại quặng chứa 60% Fe2O3; B là 1 loại quặng khác chứa 69,6% Fe3O4. Hỏi trog 1 tấn quặng nào chứa nhiều sắt hơn? Là bn kg?
2. Trộn quặng A vs quặng B theo tỉ lệ khối lượng là mA: mB= 2:5 ta dc quặng C. Hỏi trog 1 tấn quặng C có bn kg sắt?
Câu 1 :
mFe2O3 ( A ) = 0.6 tấn
mFe = (0.6/160)*112= 0.42 tấn
mFe3O4 ( B) = 0.696 tấn
mFe ( 0.696/232)*168= 0.504 tấn
=> Quặng B chứa nhiều sắt hơn
m = 0.504 - 0.42 = 0.084 tấn
Câu 2 :
Chọn tỉ lệ là : 2, 5
Trộn 2 tấn quặng A với 5 tấn quặng B thu được 7 tấn quặng C :
mFe ( C) = 2*0.42 + 5*0.504=3.36 tấn
Vậy trong 1 tấn quặng C có : 3.36/7 = 0.48 tấn
Chọn đáp án C.
Thành phần chính của quặng sắt pirit là FeS2.
a) Nếu hàm lượng % của kim loại A trong A22(CO3)x là 40% thì hàm lượng % của A trong hợp chất A3(PO4)x là bao nhiêu?
b) Quặng A chứa 60% Fe2O3, quặng B chứa 69,6% Fe2O4. Nếu trộn quặng A và quặng B theo tỉ lệ khối lượng là mA : mB = 2:5 để được quặng C thì trong 1 tấn quặng C có bao nhiêu kg Fe?
a)
M = 2A + 60x (g)
M = 3A + 95x (g)
\(\%A\left(CO3\right)=\frac{2A}{2A+60x}\cdot100\%=40\%\)
\(\Leftrightarrow2A+60x=5A\)
\(\Leftrightarrow3A=60x\)
\(\Leftrightarrow A=20x\)
\(\%A3\left(PO4\right)x=\frac{3A}{3A+95x}\cdot100\%\)
\(\Leftrightarrow\frac{3A}{3A+95\cdot\frac{A}{20}}\cdot100\%\)
\(\Leftrightarrow\frac{3A}{7.75A}\cdot100\%=38.71\%\)
b) Gọi: x là kl quặng A , y là kl quặng B
<=> x + y = 1
2x - 5y = 0
=> x = 5/7
y = 2/7
mFe ( A) = 0.6*5/7*2/160=3/560 ( tấn )
mFe ( B) = 0.696*2/7*3/232= 9/3500 (tấn )
mFe = 8 kg
Khu mỏ sắt ở Trại Cau (Thái Nguyên) có một lạo quặng sắt (thành phần chính là F e 2 O 3 ). Khi phân tích mẫu quặng này, người ta nhận thấy có 2,8g sắt. Trong mẫu quặng trên, khối lượng sắt (III) oxit F e 2 O 3 ứng với hàm lượng sắt nói trên là:
A. 6g. B. 8(g). C.4g. D.3g.
Hãy chọn đáp số đúng.
Phương trình hóa học:
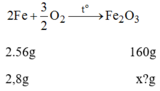
Khối lượng F e 2 O 3 ứng với lượng sắt trên là:
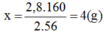
→ Chọn C.
Mọi người giúp mình với ạ ![]()
1) 60,1g Ba3(PO4)2 có chứa bao nhiêu nguyên tử O2?
2) Một muối sunfat của kim loại hóa trị (3) có chứa 15,79 % về khối lượng của kim loại trên.
a) Xác định kim loại hóa trị (3) và công thức háo học của muối sunfat?
b) Tính số nguyên tử O2 có trong lượng muối sunfat trên ?
3) a/ A là 1 quặng sắt chứa 60% Fe2O3 về khối lượng, B là 1 loại quặng sắt khác chứa 69,6% Fe3O4. Hỏi trong 1 tấn quặng A, 1 tấn quặng B chứa bao nhiêu kg Fe mỗi loại?
b/ Trộn quặng A vs quặng B theo tỉ lệ khối lượng \(\dfrac{m_A}{m_B}\) = \(\dfrac{2}{5}\) ta được quặng C. Hỏi trong mỗi tấn quặng C có bao nhiêu kg Fe trong tấn quặng C.
Làm ơn chỉ giùm mình, mình đang cần gấp.
1. nBa3(PO4)2 = 60,1/601 = 0,1 mol
(bạn xem lại đề mình nghĩ là nguyên tử O, không phải lả O2 vì O2 là phân tử )
trong Ba3(PO4)2 có 2.4= 8 nguyên tử O ⇒ nO = 8nBa3(PO4)2 = 0,8
vậy số nguyên tủ O là 0,8.(6,02.1023) = 4,816.1023
2. Gọi kim loại cần tìm là M
công thức chung của muối : M2(SO4)3
% về khối lượng = % về khối lượng mol
vì kim loại M chứa 15.79% về khối lượng nên gốc SO4 chiếm
100- 15,79 = 84,21% về khối lượng ta có
\(\dfrac{mM}{mSO4^{2-}}\) = \(\dfrac{M_M}{M_{SO4^{2-}}}\)= \(\dfrac{M_M.2}{96.3}\)= \(\dfrac{15,79}{84,21}\)⇒ MM= 27 (Al)
muối là Al2(SO4)3
Số nguyên tử O = 12 lần số phân tử Al2(SO4)3 vì trong Al2(SO4)3 CÓ 3.4=12 nguyên tử O
3. 1 tấn = 1000kg
trong 1 tấn quặng A chứa 1000.60% = 600kg Fe2O3
⇒nFe2o3 = 600/160 = 3,75 mol (mimhf không đổi ra gam nên cứ coi như Fe2O3 có số mol là 3,75 luôn vì đằng nào cũng tính khối lượng Fe theo kg )
trong 1 phân tử Fe2O3 chứa 2 nguyên tử Fe nên nFe = 2 nFe2O3
= 3,75.2 = 7,5 mol ⇒mFe = 7,5.56 = 420kg
hoặc bạn có thể tính mFe theo cách sau
\(\dfrac{mFe}{mFe2O3}\)= \(\dfrac{56.2}{160}\) ⇒ \(\dfrac{mFe}{600}\)=\(\dfrac{56.2}{160}\)⇒mFe = 420kg
tương tự bạn tính mFe trong hỗn hợp B
\(\dfrac{m_A}{m_B}\)= \(\dfrac{2}{5}\), mặt khác mA + mB = 1000
⇒ mA = (1000/7).2 = 2000/7 kg
mB = (1000/7).5 = 5000/7 kg
mFe trong C = mFe( trong A) + mFe(trong B)
bạn tính theo cách trên là ra
Cho các phát biểu sau:
(a). Quặng manhetit là loại quặng chất lượng cao trong sản xuất thép
(b). Thành phần chính của quặng boxit là Al.2H2O.
(c). Kim cương được dùng làm đồ trang sức, chế tạo mũi khoan, dao cắt thủy tinh.
(d). Ba là kim loại nhẹ.
Số phát biểu đúng là:
A. 4
B. 3
C. 1
D. 2
Chọn đáp án B.
Các phát biểu đúng là: (a), (c), (d)