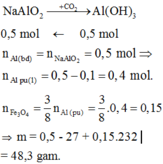Nung nóng m gam hh gồm A1 và Fe3O4 trong điều kiện không có không khí. Sau khi pư xảy ra hoàn toàn, thu được hh rắn X. Cho X t/d với dd NaOH (dư) thu được dd Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dd Y, thu được 39 gam kết tủa. Giá trị của m là
A. 45,6.
B. 48,3.
C. 36,7.
D. 57,0.