Cho 6,4 gam Cu tác dụng hoàn toàn với H 2 S O 4 đặc, nóng thì khối lượng dung dịch thu được
A. tăng thêm 6,4 gam
B. không thay đổi
C. giảm đi 6,4 gam
D. không xác định được
Hòa tan hoàn toàn 23,4 gam G gồm Al, Ni, Cu bằng dung dịch H2SO4 đặc nóng, thu được 15,12 lít khí SO2 (đktc). Nếu cho 23,4 gam G tác dụng hoàn toàn với dung dịch AgNO3 thì thấy khối lượng chất rắn tăng m% so với khối lượng G. Giá trị của m là:
A. 623,08
B. 311,54
C. 523,08
D. 411,54
Đáp án C
Tương tự các bài trước, theo định luật bào toàn mol electron, ta có:
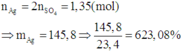
Mà đề bài hỏi khối lượng chất rắn tăng bao nhiêu phần trăm so với khối lượng G
Nên m = 623,08 – 100 = 523,08
Cho 6,4 g đồng tác dụng hoàn toàn với H2SO4 đặc, nóng. Toàn bộ khí thoát ra hấp thụ hoàn toàn vào 300ml dung dịch NaOH 1M thu được m gam muối. Giá trị của m là bao nhiêu? ( cho S = 32, Na = 23, O = 16, H= 1)
A) 25,2 g
B) 6,3 g
C)12,6g
D) 4,2 g
----------------------
Cho mình xin luôn lời giải thích
\(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right);n_{NaOH}=1\cdot0,3=0,3\left(mol\right)\\ PTHH:Cu+H_2SO_{4\left(đ\right)}\rightarrow CuSO_4+H_2O+SO_2\uparrow\\ SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\\ \Rightarrow n_{SO_2}=n_{Cu}=0,1\left(mol\right)\\ \text{Vì }\dfrac{n_{SO_2}}{1}< \dfrac{n_{NaOH}}{2}\Rightarrow NaOH\text{ dư}\\ \Rightarrow n_{Na_2SO_3}=n_{SO_2}=0,1\left(mol\right)\\ \Rightarrow m_{muối}=m_{Na_2SO_3}=0,1\cdot126=12,6\left(g\right)\)
Chọn C
Cho hỗn hợp gồm 6,4 gam Fe2O3 và 6,4 gam Cu vào 400ml dung dịch HCl 2M và khuấy đều. Khi phản ứng xảy ra hoàn toàn thì khối lượng chất rắn thu được là
A. 3,84gam
B. 5,12gam
C. 2,56 gam
D. 6,4 gam
Đáp án : A
nFe2O3 = 0,04 mol ;nCu = 0,1 mol ; nHCl = 0,8 mol
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
2FeCl3 + Cu -> CuCl2 + 2FeCl2
=> Chất rắn là (0,1 – 0,04 = 0,06) mol Cu
=> mCu = 3,84g
Cho 6,4 gam Cu và 5,6 gam Fe tác dụng với lượng dư dung dịch HCl. Sau khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là
A. 5,6 lít
B. 4,48 lit
C. 2,24 lít
D. 3,36 lít
Cho 6,4 gam Cu và 5,6 gam Fe tác dụng với lượng dư dung dịch HCl. Sau khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là
A. 5,6 lít.
B. 2,24 lít.
C. 4,48 lit.
D. 3,36 lít.
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)
Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc, nóng, dư. Sau phản ứng thu được V lít SO2 duy nhất (đktc). Giá trị của V là:
A. 6,72 lít.
B. 3,36 lít.
C. 11,2 lít.
D. 8,96 lít.
Đáp án D.
nAl = 0,2 (mol), nCu = 0,1 (mol)
Áp dụng định luật bảo toàn electron có
![]()
→ V = 0,4 . 22,4 = 8,96 lít.
Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H 2 S O 4 đặc, nóng, dư. Sau phản ứng thu được V lít S O 2 duy nhất (đktc). Giá trị của V là
A. 6,72 lít.
B. 3,36 lít.
C. 11,2 lít.
D. 8,96 lít.
Thủy phân hoàn toàn este A của axit hữu cơ đơn chức X và ancol đơn chức Y bằng dung dịch NaOH vừa đủ. Làm bay hơi hoàn toàn dung dịch sau thủy phân. Phần hơi được dẫn qua bình đựng CaCl2 khan dư. Sau khi làm khô, phần hơi còn lại cho qua bình đựng K dư thấy có khí Z bay ra và khối lượng bình đựng K tăng 6,2 gam. Dẫn khí Z qua CuO nung nóng dư sinh ra 6,4 gam Cu. Lượng este ban đầu tác dụng vừa đủ với 32 gam brom thu được sản phẩm chứa 65,04% brom về khối lượng. Tên gọi của A là
A. vinyl fomat
B. metyl metacrylat
C. vinyl axetat
D. metyl acrylat
Các phương trình xảy ra
RCOOR1 + NaOH → RCOONa + R1OH
Làm bay hơi dung dịch sau thủy phân,sau đó cho qua CaCl2 để hút hết nước,sau đó cho qua K thì có khí nên có phản ứng:
R1OH + K → ROK + 1/2H2
Cho H2 qua CuO
CuO + H2 → Cu + H2O
nCu = 0,1 mol → nH2 = 0,1 mol → nR1OK = 0,2 mol→ MR1OK = (6,2 + mH2)/0,2 = 6,4/0,2 = 32
→ R1OH là CH3OH
Ta có neste = 0,2(mol), nBr2 = 0,2(mol)
→ Este có 1 liên kết đôi ở ngoài mạch C
→ Este có M là 86
→ Đáp án D