Chọn 4 loại oxit được điều chế trực tiếp mà không xuất phát từ khí oxi. Cho ví dụ cụ thể.

Những câu hỏi liên quan
2. Đốt kim loại R trong khí oxi dư thu được chất rắn X1, trong phân tử X1 nguyên tố oxi chiếm 20%về khối lượng. Từ R hoặc X1 có thể điều chế trực tiếp các muối X2, X3. Từ X1 không thể điều chế trựctiếp được X4. Biết phân tử khối (M) của các chất thỏa mãn MX1 MX4 MX2 MX3. Xác định R, chọnmột bộ chất X1, X2, X3, X4 phù hợp và viết các phương trình hóa học.
Đọc tiếp
2. Đốt kim loại R trong khí oxi dư thu được chất rắn X1, trong phân tử X1 nguyên tố oxi chiếm 20%
về khối lượng. Từ R hoặc X1 có thể điều chế trực tiếp các muối X2, X3. Từ X1 không thể điều chế trực
tiếp được X4. Biết phân tử khối (M) của các chất thỏa mãn MX1 < MX4 < MX2 < MX3. Xác định R, chọn
một bộ chất X1, X2, X3, X4 phù hợp và viết các phương trình hóa học.
R là Cu
X1 là CuO, X2 là CuSO4, X3 là Cu(NO3)2, X4 là Cu(OH)2
PTHH:
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
\(CuO+2HNO_3\rightarrow Cu\left(NO_3\right)_2+H_2O\)
\(Cu+4HNO_{3\left(đ\right)}\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\)
Đúng 2
Bình luận (0)
Oxit Y của một nguyên tố X ứng với hóa trị II có thành phần % theo khối lượng của X là 42,86%. Trong các mệnh đề sau: (1) Y tan nhiều trong nước. (2) Liên kết X với O trong Y là liên kết ba. (3) Y có thể điều chế trực tiếp từ phản ứng giữa X và hơi nước nóng. (4) Từ axit fomic có thể điều chế được Y. (5) Từ Y, bằng một phản ứng trực tiếp có thể điều chế được axit etanoic. (6) Y là khí không màu, không mùi, không vị, có tác dụng điều hòa không khí. Số mệnh đề đúng khi nói về X và Y là A. ...
Đọc tiếp
Oxit Y của một nguyên tố X ứng với hóa trị II có thành phần % theo khối lượng của X là 42,86%. Trong các mệnh đề sau:
(1) Y tan nhiều trong nước.
(2) Liên kết X với O trong Y là liên kết ba.
(3) Y có thể điều chế trực tiếp từ phản ứng giữa X và hơi nước nóng.
(4) Từ axit fomic có thể điều chế được Y.
(5) Từ Y, bằng một phản ứng trực tiếp có thể điều chế được axit etanoic.
(6) Y là khí không màu, không mùi, không vị, có tác dụng điều hòa không khí.
Số mệnh đề đúng khi nói về X và Y là
A. 3
B. 4
C. 5
D. 6
Đáp án B.
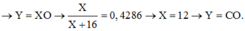
Mệnh đề đúng là: (2); (3); (4); (5).
(1) CO tan ít trong nước.
(2) C = O .
(3) C + H2O → CO + H2.
(4) H C O O H → H 2 O + C O 2
(5) C H 3 O H + C O → C H 3 C O O H
(6) Y là khí không màu, không mùi, không vị, rất độc.
Đúng 0
Bình luận (0)
Oxit Y của một nguyên tố X ứng với hóa trị II có thành phần % theo khối lượng của X là 42,86%. Trong các mệnh đề sau: (1) Y tan nhiều trong nước. (2) Liên kết X với O trong Y là liên kết ba. (3) Y có thể điều chế trực tiếp từ phản ứng giữa X và hơi nước nóng. (4) Từ axit fomic có thể điều chế được Y. (5) Từ Y, bằng một phản ứng trực tiếp có thể điều chế được axit etanoic. (6) Y là khí không màu, không mùi, không vị, có tác dụng điều hòa không khí. Số mệnh đề đúng khi nói về X và Y là A. 3...
Đọc tiếp
Oxit Y của một nguyên tố X ứng với hóa trị II có thành phần % theo khối lượng của X là 42,86%. Trong các mệnh đề sau:
(1) Y tan nhiều trong nước.
(2) Liên kết X với O trong Y là liên kết ba.
(3) Y có thể điều chế trực tiếp từ phản ứng giữa X và hơi nước nóng.
(4) Từ axit fomic có thể điều chế được Y.
(5) Từ Y, bằng một phản ứng trực tiếp có thể điều chế được axit etanoic.
(6) Y là khí không màu, không mùi, không vị, có tác dụng điều hòa không khí.
Số mệnh đề đúng khi nói về X và Y là
A. 3
B. 4
C. 5
D. 6
Đáp án B.
Y=XO
=> X/(X+16)=0,4286
=> X=12; Y=CO
Mệnh đề đúng là: (2); (3); (4); (5).
(1) CO tan ít trong nước.
(2) ![]()
(3) C + H2O ![]() CO + H2.
CO + H2.
(4) ![]()
(5) ![]()
(6) Y là khí không màu, không mùi, không vị, rất độc.
Đúng 0
Bình luận (0)
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cu thí nghiệm như hình vẽ. Hãy chọn câu trả lời đúng trong các câu sau: A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi. B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí. C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro. D. Có thể dùng để điều chế hidro nhưng không thu được khí hiđro.
Đọc tiếp
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cu thí nghiệm như hình vẽ. Hãy chọn câu trả lời đúng trong các câu sau:
A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi.
B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí.
C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro.
D. Có thể dùng để điều chế hidro nhưng không thu được khí hiđro.
Câu trả lời đúng là C.
PT: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Từ phản ứng này ⇒ có thể điều chế khí H2
Khí H2 nhẹ hơn không khí nên úp ngược ống nghiệm sẽ thu được khí H2
Đúng 0
Bình luận (0)
Cho các phát biểu sau: (1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn), … (2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp (3) Khí ozon không màu, không mùi, tan nhiều trong nước (4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi (5) Ozon oxi hóa hầu hết các kim loại kể cả Au, Pt (6) Ở điều kiện bình thường, oxi và ozon có thể oxi hóa bạc thành bạc oxit Số phát biểu đúng là: A.2 B.1 ...
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn), …
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp
(3) Khí ozon không màu, không mùi, tan nhiều trong nước
(4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi
(5) Ozon oxi hóa hầu hết các kim loại kể cả Au, Pt
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hóa bạc thành bạc oxit
Số phát biểu đúng là:
A.2
B.1
C.3
D.4
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),
(4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi
ĐÁP ÁN A
Đúng 0
Bình luận (0)
Cho các phát biểu sau:(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),...(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp.(3) Khí ozon không màu, không mùi, tan nhiều trong nước.(4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon.(5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt.(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit. Số phát biểu đúng là: A. 2. B. 1. C. 3. D. 4.
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),...
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp.
(3) Khí ozon không màu, không mùi, tan nhiều trong nước.
(4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon.
(5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt.
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit.
Số phát biểu đúng là:
A. 2.
B. 1.
C. 3.
D. 4.
Đáp án A
Các trường hợp thoả mãn: 1 – 4
Đúng 0
Bình luận (0)
Cho các phát biểu sau: (1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),... (2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp. (3) Khí ozon không màu, không mùi, tan nhiều trong nước. (4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon. (5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt. (6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit. Số phát biểu đúng là: A. 2. B. 1. C. 3. D. 4
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),...
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp.
(3) Khí ozon không màu, không mùi, tan nhiều trong nước.
(4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon.
(5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt.
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit.
Số phát biểu đúng là:
A. 2.
B. 1.
C. 3.
D. 4
ĐÁP ÁN A
Các trường hợp thoả mãn: 1 – 4
Đúng 0
Bình luận (0)
Oxit Y của một nguyên tố X ứng với hóa trị II có thành phần % theo khối lượng của X là 42,86%. Trong các mệnh đề sau: (I) Y tan nhiều trong nước (II) Y có thể điều chế trực tiếp từ phản ứng của X với hơi nước nóng (III) Từ axit fomic có thể điều chế được Y (IV) Từ Y bằng một phản ứng trực tiếp có thể điều chế được axit etanoic (V) Y là một khí không màu, không mùi, không vị, có tác dụng điều hòa không khí (VI) Hidroxit của X có tính axit mạnh hơn Axit silixic Số mệnh đề đúng khi nói về X và Y là...
Đọc tiếp
Oxit Y của một nguyên tố X ứng với hóa trị II có thành phần % theo khối lượng của X là 42,86%. Trong các mệnh đề sau:
(I) Y tan nhiều trong nước
(II) Y có thể điều chế trực tiếp từ phản ứng của X với hơi nước nóng
(III) Từ axit fomic có thể điều chế được Y
(IV) Từ Y bằng một phản ứng trực tiếp có thể điều chế được axit etanoic
(V) Y là một khí không màu, không mùi, không vị, có tác dụng điều hòa không khí
(VI) Hidroxit của X có tính axit mạnh hơn Axit silixic
Số mệnh đề đúng khi nói về X và Y là?
A. 4
B. 3
C. 6
D. 5
Đáp án A
Phương pháp: Ghi nhớ CT tính phần trăm của A có trong AXBYCZ là:
%A = (x.MA / MAxByCz). M AxByCz .100%
Hướng dẫn giải:
Công thức của Y là XO
=> %X = X/(X+ 16) = 42,86%
=> X = 12
Vậy Y là CO
(1) Sai
(2) Đúng: C + H2O → CO + H2
(3) Đúng: HCOOH →CO + H2O (H2SO4 đặc xt)
(4) Đúng: CO + CH3OH → CH3COOH
(5) Sai
(6) Đúng, H2CO3 mạnh hơn H2SiO3
Đúng 0
Bình luận (0)
Bài 3: Tính khối lượng KMnO4 cần điều chế được lượng oxi đủ phản ứng cho 36 g kim loại sắt. (sp Fe3O4) Bài 4: Khi đốt cháy nhôm trong khí oxi thu được nhôm oxit Al2O3. a) Tính khối lượng Nhôm và thể tích khí oxi (đktc) cần dùng để điều chế 51 gam nhôm oxit. b) Tính khối lượng kali pemanganat cần dùng để điều chế lượng khí oxi nói trên. c) Tính khối lượng kali clorat cần dùng để điều chế lượng khí oxi nói trên.Bài 5: Khi đốt cháy hoàn toàn 14,4 gam Mg trong bình chứa 4,48 lít O2...
Đọc tiếp
Bài 3: Tính khối lượng KMnO4 cần điều chế được lượng oxi đủ phản ứng cho 36 g kim loại sắt. (sp Fe3O4)
Bài 4: Khi đốt cháy nhôm trong khí oxi thu được nhôm oxit Al2O3.
a) Tính khối lượng Nhôm và thể tích khí oxi (đktc) cần dùng để điều chế 51 gam nhôm oxit.
b) Tính khối lượng kali pemanganat cần dùng để điều chế lượng khí oxi nói trên.
c) Tính khối lượng kali clorat cần dùng để điều chế lượng khí oxi nói trên.
Bài 5: Khi đốt cháy hoàn toàn 14,4 gam Mg trong bình chứa 4,48 lít O2 (đktc) thu được m gam hỗn hợp chất rắn. Giá trị của là ?
Bài 6: Đốt cháy hoàn toàn 12,8 gam Cu cần vừa đủ V lít không khí (đktc) thu được m gam CuO. Tính giá trị của m và V. Biết trong không khí oxi chiếm 20% thể tích.
Bài 7: Nung 79 gam KMnO4 thu được V lít khí O2 đo ở đktc. Biết hiệu suất phản ứng nhiệt phân là 80%, hãy tính giá trị của V ?
Bài 8: Nung 24,5 gam KClO3 thu được V lít khí O2 đo ở đktc. Biết hiệu suất phản ứng nhiệt phân là 50%, hãy tính giá trị của V ?
Bài 9: Nung m gam KClO3 thu được 6,72 lít khí O2 đo ở đktc. Biết hiệu suất phản ứng nhiệt phân là 70%, hãy tính giá trị của m ?
Bạn tách ra từng câu nhé!
Bài 3.
\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{36}{56}=0,6428mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,6428 ----- 0,4285 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,857 0,4285 ( mol )
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=0,857.158=135,406g\)
Bài 4.
a.\(n_{Al_2O_3}=\dfrac{m_{Al_2O_3}}{M_{Al_2O_3}}=\dfrac{51}{102}=0,5mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
1 0,75 0,5 ( mol )
\(m_{Al}=n_{Al}.M_{Al}=1.27=27g\)
\(V_{O_2}=n_{O_2}.22,4=0,75.22,4=16,8l\)
b.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
1,5 0,75 ( mol )
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=1,5.158=237g\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
0,5 0,75 ( mol )
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=0,5.122,5=61,25g\)
Đúng 1
Bình luận (0)
Bài 5.
\(n_{Mg}=\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{14,4}{24}=0,6mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Mg+O_2\rightarrow\left(t^o\right)2MgO\)
0,6 < 0,2 ( mol )
0,4 0,2 0,2 ( mol )
\(m_{MgO}=n_{MgO}.M_{MgO}=0,2.40=8g\)
Bài 6.
\(n_{Cu}=\dfrac{m_{Cu}}{M_{Cu}}=\dfrac{12,8}{64}=0,2mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,2 0,1 0,2 ( mol )
\(V_{kk}=V_{O_2}.5=\left(0,1.22,4\right).5=2,24.5=11,2l\)
\(m_{CuO}=n_{CuO}.M_{CuO}=0,2.80=16g\)
Đúng 2
Bình luận (1)












