Các ion O 2 - 8 ; Mg 2 + 12 ; Al 3 + 13 bằng nhau về
A. số khối
B. số electron
C. số proton
D. số nơtron
Sự phân bố electron trên các lớp của ion X - là 2/8/8. X - có 18 nơtron trong hạt nhân. Số khối của ion X - là
A. 34
B. 35
C. 36
D. 37
B
Ion X- có 18 electron => Nguyên tử X có 17 electron trong vỏ nguyên tử và có 17 proton trong hạt nhân.
Vậy số khối của X là 17 + 18 = 35.
Cho số thứ tự của các nguyên tố N (Z = 7), O (Z = 8). Tổng số hạt electron của ion N O 3 - là
A. 31
B. 32.
C. 17
D. 24
Cho các chất và ion : Mn, MnO, MnCl 4 , MnO 4 - Số oxi hoá của Mn trong các chất và ion trên lần lượt là
A. +2 , -2, -4, +8. B. 0, +2, +4, +7.
C. 0, -2, -4, -7. D. 0, +2, -4, -7
Cho các nguyên tử: N (Z=7), Cl (Z=17), O (Z=8) và F (Z=9). Bán kính ion được sắp xếp tăng dần theo thứ tự
A.N3-, O2-, F-, Cl-
B. Cl- N3-, O2-, F-
C. F-, O2-, N3-,Cl-
D. Cl-; F-, O2-, N3-
Đáp án C
+ Khi sắp xếp bán kính nguyên tử hay ion thì ưu tiên số lớp e (chu kì) trước
+ Sau đó cùng chu kì thì chất nào có Z nhỏ thì bán kính sẽ lớn
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na -> Na+ ; Cl -> Cl-
Mg -> Mg2+ ; S -> S2-
Al -> Al3+ ; O -> O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
Trong một từ trường đều có vectơ B thẳng đứng, cho một dòng các ion bắt đầu đi vào từ điểm A và đi ra tại C sao cho AC là 1/2 đường tròn trong mặt phẳng ngang. Các ion có cùng điện tích, cùng vận tốc đầu. Cho biết khoảng cách AC đối với ion C2 H5 O+ là 22,5cm. Xác định khoảng cách AC đối với các ion C2 H5 OH+,C2 H5 +,OH+,CH2 OH+,CH3+,CH2+.
Trong từ trường đều B, ion C2H5O+ (m1 = 45đvC) chuyển động tròn với bán kính R1.
Ta có: 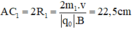
- Đối với ion C2H5OH (m2 = 46đvC)
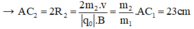
- Đối với ion C2H5+ (m3 = 29đvC)
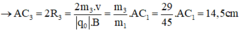
- Đối với ion OH+ (m4 = 17đvC)
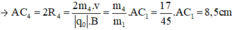
- Đối với ion CH2OH+ (m5 = 31đvC)
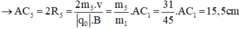
- Đối với ion CH3+ (m6 = 15đvC)
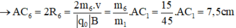
- Đối với ion CH2+ (m7 = 14đvC)
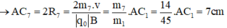
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na -> Na+ ; Cl -> Cl-
Mg -> Mg2+ ; S -> S2-
Al -> Al3+ ; O -> O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
Câu 2: Xác định số oxi hoá của các nguyên tố có trong các ion sau
OH-, CO32-, PO43-, MnO4-, HCO3-, ClO-, Cr2O72-
Câu 3: Xác định số oxi hoá của S có trong các chất và ion sau:
S, SO2, SO3, H2S, H2SO3, H2SO4, Na2SO4, SO32-, SO42-
Câu 4: Xác định số oxi hoá của N có trong các chất và ion sau:
N2, NO, NO2, N2O, N2O5, HNO3, NH4+, NO3-, Fe(NO3)3, NH4NO3
mình cần gấp ạ
Cho các ion: Na+ , Mg2+, O2-, Cl-. Những ion nào có thể kết hợp với nhau tạo thành liên kết ion?
Những ion có thể kết hợp với nhau là:
`@ Na^[+]` và `O^[2-]`
`@Na^[+]` và `Cl^[-]`
`@Mg^[2+]` và `O^[2-]`
`@Mg^[2+]` và `Cl^[-]`