Vẽ biểu đồ là những hình chữ nhật để so sánh thể tích những khí sau ở đktc. 1g khí hidro; 24g khí oxi; 28g khí nito; 88g khí cacbonic

Những câu hỏi liên quan
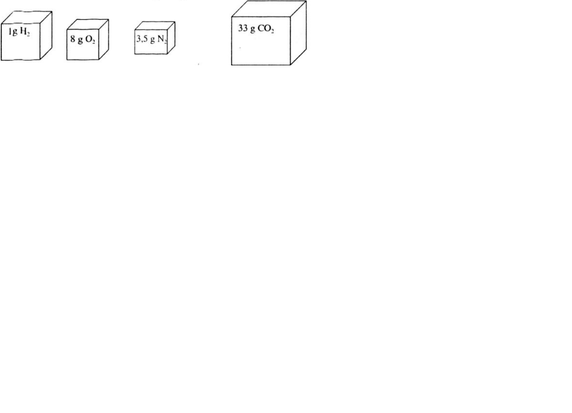
Hãy vẽ những hình khối chữ nhật để so sánh thể tích các khí sau (đktc): 1gH2 ; 8g O2 ; 3,5gN2 ; 33gCO2
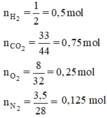
Sơ đồ biểu thị về tỉ lệ thể tích của các khí.
Tỉ lệ số mol các chất khí cũng chính là tỉ lệ về thể tích các khí nên thể tích khí VCO2 > VH2 > VO2 > VN2.
Đúng 0
Bình luận (0)
Hãy xác định khối lượng và thể tích của những hỗn hợp khí sau ở đktc: 6g hidro + 2,2g khí cacbonic + 1,6g khí oxi.
m h h = m H 2 + m C O 2 + m O 2 = 6 + 2,2 + 1,6 = 9,8g
n H 2 = m : M = 6 : 2 = 3 mol;
n C O 2 = m : M = 2,2 : (12 + 16.2) = 0,05 mol
n O 2 = m : M = 1,6 : 32 = 0,05 mol
V h h = 22,4. n h h = 22,4.(3 + 0,05 + 0,05) = 69,44 (l)
Đúng 0
Bình luận (0)
Hãy vẽ những hình khối chữ nhật để so sánh thể tích các khí sau (đktc):
1g H2; 8 g O2; 3,5 g N2; 33 g CO2.
Trước tiên ta cần chuyển đổi khối lượng các khí ra số mol phân tử. Số mol của các chất khí:
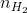 =
=  = 0,5 mol;
= 0,5 mol; 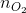 =
= 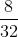 = 0,25 mol
= 0,25 mol
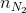 =
= 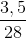 = 0,125 mol;
= 0,125 mol; 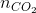 =
= 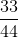 = 0,75 mol.
= 0,75 mol.
Tỉ lệ về số mol các khí cũng là tỉ lệ về thể tích các chất khí ở cùng một điều kiện, ta có sơ đồ biểu diễn:
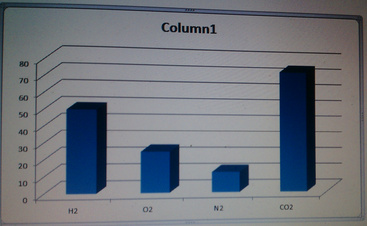
Đúng 1
Bình luận (1)

nH2 = 1 /2 = 0,5 mol nO2 = 8/32 = 0,25 mo nN2 = 3,5 / 28 = 0,125 mo nCO2 = 33 / 44 = 0,75mol Sơ đồ biểu thị về tỉ lệ thể tích của các khí (hình trên). Tỉ lệ số mol các chất khí cũng chính là tỉ lệ về thể tích các khí, nên thể tích khí Vco2 > VH2 > VO2 > VN2
Đúng 0
Bình luận (0)
Trước tiên ta cần chuyển đổi khối lượng các khí ra số mol phân tử. Số mol của các chất khí:
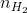 =
=  = 0,5 mol;
= 0,5 mol; 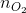 =
= 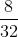 = 0,25 mol
= 0,25 mol
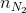 =
= 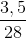 = 0,125 mol;
= 0,125 mol; 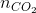 =
= 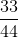 = 0,75 mol.
= 0,75 mol.
Tỉ lệ về số mol các khí cũng là tỉ lệ về thể tích các chất khí ở cùng một điều kiện, ta có sơ đồ biểu diễn:
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 28ml khí Hidro cháy trong 20ml khí Oxi
1. Tính khối lượng nước tạo thành ở thể lỏng
2. Tính thể tích của nước tạo thành nói trên (Các khí đó ở đktc và khối lượng riêng của nước là 1g/ml)
VH2 = 0,028 ( l )
=> nH2 = 0,028 / 22,4 = 0,00125 (mol)
VO2 = 0,02(l)
= > nO2 = 0,02 / 22,4 = 0,00089 (mol)
\(2H_2+O_2\underrightarrow{đp}2H_2O\)
2 1 2 (mol)
0,00125 0,00125 (mol)
LTL : \(\dfrac{0,00125}{2}< \dfrac{0,0089}{1}\)
=> H2 đủ , O2 dư
\(mH_2O=0,00125.18=0,0225\left(g\right)\)
Áp dụng ct tính V : \(V=\dfrac{m}{D}\)
=> \(VH_2O=\dfrac{mH_2O}{DH_2O}=\dfrac{0,0225}{1}=0,0225\left(l\right)\)
Đúng 1
Bình luận (0)
Một lượng khí không đổi ở trạng thái 1 có thể tích V1, áp suất p1, dãn đẳng nhiệt đến trạng thái 2 có thể tích V2 2V1 và áp suất
p
2
p
1
2
. Sau đó dãn đẳng áp sang trạng thái 3 có thể tích V3 3V1.Vẽ đồ thị biểu diễn các quá trình trên, dùng đồ thị để so sánh công của khí trong các quá trình trên
Đọc tiếp
Một lượng khí không đổi ở trạng thái 1 có thể tích V1, áp suất p1, dãn đẳng nhiệt đến trạng thái 2 có thể tích V2 = 2V1 và áp suất p 2 = p 1 2 . Sau đó dãn đẳng áp sang trạng thái 3 có thể tích V3 = 3V1.
Vẽ đồ thị biểu diễn các quá trình trên, dùng đồ thị để so sánh công của khí trong các quá trình trên
Đồ thị được biểu diễn trên hình 122
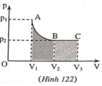
Nhận xét: Diện tích hình A V 1 V 2 B (phần gạch chéo) lớn hơn diện tích hình B V 2 V 3 C (phần nét chấm) nên công trong quá trình đẳng nhiệt ( A → B ) lớn hơn công trong quá trình đẳng áp ( B → C ).
Đúng 0
Bình luận (0)
Hãy xác định khối lượng và thể tích của những hỗn hợp khí sau ở đktc: 1,5N phân tử oxi + 2,5N phân tử hidro + 0,02N phân tử nito.
m O 2 = n O 2 . M O 2 = 1,5 .32 = 48 g
m N 2 = n N 2 . M N 2 = 0,02 . 28 = 0,56 g
m H 2 = n H 2 . M H 2 = 2,5 .2 = 5g
Khối lượng hỗn hợp khí:
m h h = m O 2 + m H 2 + m N 2 = 48 + 5 + 0,56 = 53,56(g)
Thể tích của hỗn hợp khí:
V h h = 22,4.n = 22,4.( 1,5 + 2,5 + 0,02) = 90,048 (l)
Đúng 0
Bình luận (0)
Căn cứ vào đồ thị về độ tan của chất khí trong nước (Hình 6.6, SGK), hãy ước lượng độ tan của các khí NO,
O
2
và
N
2
ở
20
0
C
. Hãy chuyển đổi có bao nhiêu ml những khí trên tan trong 1 lit nước? Biết rằng ở
20
0
C
và 1 atm, 1mol chất khí có thể tích là 24lit và khối lượng riêng của nước là 1...
Đọc tiếp
Căn cứ vào đồ thị về độ tan của chất khí trong nước (Hình 6.6, SGK), hãy ước lượng độ tan của các khí NO, O 2 và N 2 ở 20 0 C . Hãy chuyển đổi có bao nhiêu ml những khí trên tan trong 1 lit nước? Biết rằng ở 20 0 C và 1 atm, 1mol chất khí có thể tích là 24lit và khối lượng riêng của nước là 1g/ml.
Theo đồ thị về độ tan của chất khí trong nước cùng nhiệt độ, áp suất:
S N O = 0,006g/100g H2O
S O 2 = 0,0045g/100g H2O
S N 2 = 0,002g/ 100g H2O
* Chuyển đổi độ tan của các chất khí trên theo ml/1000ml H 2 O

Đúng 0
Bình luận (0)
Câu hỏi : Cho 5,6 lít nước hidro tác dụng với 3,2g khíc Oxi tạo ra nướca) Viết phương trình hóa học b) Khí Oxi và khí hidro ,chất nào dư sau phân tử tính thể tích khí dư.Biết thể tích các khí đo ở đktc c) Tính Khối lượng nước thu được bằng 2 cách?d) Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi bằng 1/5 thể tích ko khí?
Đọc tiếp
Câu hỏi : Cho 5,6 lít nước hidro tác dụng với 3,2g khíc Oxi tạo ra nước
a) Viết phương trình hóa học
b) Khí Oxi và khí hidro ,chất nào dư sau phân tử tính thể tích khí dư.Biết thể tích các khí đo ở đktc
c) Tính Khối lượng nước thu được bằng 2 cách?
d) Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi bằng 1/5 thể tích ko khí>?
- Bạn ơi, 5,6 lít của nước hay hiđro
Đúng 1
Bình luận (1)
a) 2H2 +O2 -->2H2O
b) nH2=5,6/22,4=0,25(mol)
nO2=3,2/16=0,2(mol)
lập tỉ lệ :
\(\dfrac{0,25}{2}< \dfrac{0,2}{1}\)
=> H2 hết , O2 dư =>bài toán tính theo H2
theo PTHH : nO2=1/2nH2=0,125(mol)
nO2(dư)=0,2 -0,125=0,075(mol)
=>VO2(dư)=0,075.22,4=1,68(l)
c)
C1 : theo PTHH :nH2O=nH2=0,25(mol)
=>mH2O=0,25.18=4,5(g)
C2: mH2=0,25.2=0,5(g)
mO2(phản ứng)=0,125.32=4(g)
áp dụng định luật bảo toàn khối lượng ta có :
mH2O=4 +0,5=4,5(g)
d) Vo2(đktc)=0,125.22,4=2,8(l)
=> Vkk=2,8 : 1/5=14(l)
Đúng 0
Bình luận (0)
mik sửa lại:
nO2=3,2/32=0,1(mol)
lập tỉ lệ :
\(\dfrac{0,1}{1}< \dfrac{0,25}{2}\)
=>O2 hết ,H2 dư =>bài toán tính theo O2
theo PTHH :
nH2=2nO2=0,2(mol)
=>nH2(dư)=0,25 -0,2=0,05(mol)
=>VH2(dư)=0,05.22,4=1,12(l)
c) C1:
theo PTHH : nH2O=2nO2=0,2(mol)
=>mH2O=0,2.18=3,6(g)
C2: mH2=0,2.2=0,4(g)
áp dụng định luật bảo toàn khối lượng ta có :
mH2O=0,4 +3,2=3,6(g)
d) VO2=0,1.22,4=2,24(l)
=>Vkk=2,24 :1/5=11,2(l)
Đúng 0
Bình luận (0)
vẽ biểu dồ so sánh khối lượng của 11,2g của oxi, hidro, clo, amoniac ( thể tích đo ở đktc)

















