Hỗn hợp C 2 H 2 và O 2 với tỉ lệ nào về thể tích thì phản ứng cháy sẽ tạo ra nhiệt độ ca nhất? Ứng dụng phản ứng này để làm gì?

Những câu hỏi liên quan
Hỗn hợp khí A gồm 2 chất hữu cơ là Butan C4H10 và axetylen C2H2 có tỉ lệ số phân tử là 1:1. Đem đốt cháy 8,96 lít hỗn hợp A trong 1 bình thép có chứa 21,84 lít O2. Phản ứng xong thu được CO2 và H2O. Biết rằng trong quá trình phản ứng tỉ lệ số mol O2 đốt cháy C4H10 với số mol O2 đốt cháy C2H2 là 2:1. Các thể tích khí đều đc đo ở đktc.a)Viết các phương trình phản ứng xảy ra.b) Sau phản ứng hỗn hợp A có phản ứng hết hay ko? Nếu thừa thì thừa bao nhiêu lít.
Đọc tiếp
Hỗn hợp khí A gồm 2 chất hữu cơ là Butan C4H10 và axetylen C2H2 có tỉ lệ số phân tử là 1:1. Đem đốt cháy 8,96 lít hỗn hợp A trong 1 bình thép có chứa 21,84 lít O2. Phản ứng xong thu được CO2 và H2O. Biết rằng trong quá trình phản ứng tỉ lệ số mol O2 đốt cháy C4H10 với số mol O2 đốt cháy C2H2 là 2:1. Các thể tích khí đều đc đo ở đktc.
a)Viết các phương trình phản ứng xảy ra.
b) Sau phản ứng hỗn hợp A có phản ứng hết hay ko? Nếu thừa thì thừa bao nhiêu lít.
Một loại cao su buna-N được tạo ra do phản ứng đồng trùng hợp giữa buta-1,3-đien với acrilonitrin
C
H
2
C
H
-
C
N
. Đốt cháy hoàn toàn cao su buna-N với không khí vừa đủ, sau đó đưa hỗn hợp sau phản ứng về
136
٫
5
°
C
thu được hỗn hợp khí Y chứ...
Đọc tiếp
Một loại cao su buna-N được tạo ra do phản ứng đồng trùng hợp giữa buta-1,3-đien với acrilonitrin C H 2 = C H - C N . Đốt cháy hoàn toàn cao su buna-N với không khí vừa đủ, sau đó đưa hỗn hợp sau phản ứng về 136 ٫ 5 ° C thu được hỗn hợp khí Y chứa 14,41% C O 2 về thể tích. Tỉ lệ mắt xích giữa buta-1,3-đien và acrilonitrin là
A. 1 : 2.
B. 2 : 1.
C. 2 : 3.
D. 3 : 2.
Chọn đáp án C
Gọi tỷ lệ mắt xích giữa buta-1,3-dien và acrilonitrin là 1:n
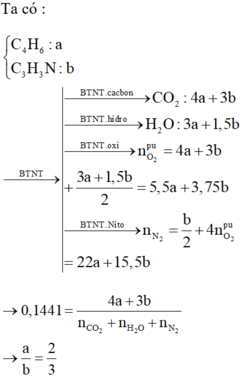
→ C 4 + 3 n H 6 + 3 n N n → + O 2 k k C O 2 : 4 + 3 n H 2 O : 3 + 1 ٫ 5 n N 2 : 0 ٫ 5 n + 4 . 4 + 3 n + 1 ٫ 5 + 0 ٫ 75 n = 15 ٫ 5 n + 22
→ % C O 2 = 4 + 3 n 4 + 3 n + 15 ٫ 5 n + 22 + 3 + 1 ٫ 5 n = 4 + 3 n 20 n + 29 = 0 ٫ 1441
→ n = 1 ٫ 5
Đúng 0
Bình luận (0)
Cho 6,72 lít (đktc) hỗn hợp khí gồm O2 và SO2 có tỉ lệ thể tích 1 : 2.
Đun nóng hỗn hợp trên với xúc tác thích hợp tạo ra SO3.Sau khi dừng phản ứng thu được 4,928 lít hỗn hợp khí.
a.Tính thể tích SO3(đktc).
b.Tính hiệu suất phản ứng.
Cao su buna-N được tạo ra do phản ứng đồng trùng hợp giữa buta-1,3-đien với acrilonitrin. Đốt cháy hoàn toàn một lượng cao su buna-N với không khí vừa đủ ( chứa 80% nito và 20% oxi về thể tích), sau đó đưa hỗn hợp sau phản ứng về 136,5 độ C thu được hỗn hợp khí và hơi Y ( chứa 14,41% CO2 về thể tích). Tính tỉ lệ số mắt xích giữa buta-1,3-đien và acrilonitrin.
Đọc tiếp
Cao su buna-N được tạo ra do phản ứng đồng trùng hợp giữa buta-1,3-đien với acrilonitrin. Đốt cháy hoàn toàn một lượng cao su buna-N với không khí vừa đủ ( chứa 80% nito và 20% oxi về thể tích), sau đó đưa hỗn hợp sau phản ứng về 136,5 độ C thu được hỗn hợp khí và hơi Y ( chứa 14,41% CO2 về thể tích). Tính tỉ lệ số mắt xích giữa buta-1,3-đien và acrilonitrin.
CH2 =CH-CH=CH2 + CH2=CH-CN -> Cao su buna-N .Do đó ta dùng phương pháp quy đổi quy cao su buna –N thành CH2 =CH-CH=CH2 (C4H6) và CH2=CH-CN (C3H3N) .Vậy đốt Cao su buna-N coi như đốt C4H6 và C3H3N
C4H6 + 5,5O2 --------> 4CO2 + 3H2O
a mol - -> 5,5a ------------- > 4a ---------------- > 3a
2C3H3N + 7,5O2 ------> 6CO2 + 3H2O + N2
b mol --->3,75b -------- > 3b ------ > 1,5b --- > 0,5b
Coi n không khí = 1 mol => nO2 pư =0,2 mol ; nN2 =0,8 mol
Vì ở nhiệt độ 136,50C nên H2O cũng ở thể khí ( hơi ) .Vậy :
Tổng số mol CO2 = 4a + 3b) mol
Tổng số mol H2O = 3a + 1,5b) mol
Tổng số mol N2 = 0,5b + 0,8) mol
=> Tổng số mol khí sau phản ứng = 4a + 3b) +3a + 1,5b) +0,5b + 0,8) =7a +5b +0,8) mol
Trong cùng điều kiện % về thể tích cũng là % về số mol .Ta có hệ

Tỉ lệ số mol C4H6 và C3H3N cũng chính là tỉ lệ mắt xích giữa buta-1,3-đien và acrilonitrin
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn một hỗn hợp gồm H2 và CO có khối lượng là 68g thì dùng hết 49,6l khí O2 ở đktc. Biết tỉ lệ số mol của hai sản phẩm là 3:1
a/ Viết các PT phản ứng xảy ra
b/ Tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp ban đầu
Sai đề rồi hay sao á bạn, sửa 49,6l thành 89,6l nhé!
a. PTHH: \(2H_2+O_2\rightarrow2H_2O\\ xmol:\dfrac{x}{2}mol\rightarrow xmol\)
\(2CO+O_2\rightarrow2CO_2\\ ymol:\dfrac{y}{2}mol\rightarrow ymol\)
b. Gọi x là số mol của \(H_2\) , y là số mol của \(CO\)
\(m_{hh}=m_{H_2}+m_{CO}\Leftrightarrow2x+28y=68\left(g\right)\left(1\right)\)
\(n_{O_2}=\dfrac{89,6}{22,4}=4\left(mol\right)\Leftrightarrow\dfrac{x}{2}+\dfrac{y}{2}=4\left(mol\right)\)
\(\Leftrightarrow x+y=8\left(2\right)\)
Giải (1) và (2) ta được: \(\left\{{}\begin{matrix}x=6\\y=2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}V_{H_2}=22,4.6=134,4\left(l\right)\\V_{CO}=22,4.2=44,8\left(l\right)\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{134,4}{134,4+44,8}.100\%=75\%\\V_{CO}=25\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho hỗn hợp khí X gồm 3 hidrocacbon và hỗn hợp khí Y gồm O2, O3 (tỉ khối hơi so với hidro bằng 19). Trộn X với Y theo tỉ lệ Thể tích VX : VY 1 : 2 rồi đốt cháy hỗn hợp thu được, sau phản ứng chỉ có CO2 và H2O theo tỉ lệ A. 10,75 B. 43,00 C. 21,50 D. 16,75
Đọc tiếp
Cho hỗn hợp khí X gồm 3 hidrocacbon và hỗn hợp khí Y gồm O2, O3 (tỉ khối hơi so với hidro bằng 19). Trộn X với Y theo tỉ lệ Thể tích VX : VY = 1 : 2 rồi đốt cháy hỗn hợp thu được, sau phản ứng chỉ có CO2 và H2O theo tỉ lệ
A. 10,75
B. 43,00
C. 21,50
D. 16,75
Đáp án A
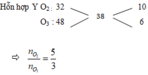
Giả sử số mol của Y = 0,8 mol => nX = 0,4mol
Bảo toàn nguyên tố O => 2nO2 + 3nO3 = 2nCO2 + nH2O = 1,9
nCO2 : nH2O = 6:7
=> nCO2 = 0,6 và nH2O = 0,7 mol
mX = mC + mH = 0,6 . 12 + 0,7 . 2 = 8,6g
=> MX = 8,6 : 0,4 = 21,5
dX/H2 = 10,75
Đúng 0
Bình luận (0)
X và Y là hai hợp chất hữu cơ chứa C, H, O và chỉ có một loại nhóm chức. Khi tác dụng với dung dịch AgNO3 trong NH3 dư thì từ 1 mol hỗn hợp X và Y tạo ra 4 mol Ag. Mặt khác khi đốt cháy X và Y thì tỉ lệ số mol O2 phản ứng và số mol CO2; H2O hình thành như sau: - Với X:
n
C
O
2
:...
Đọc tiếp
X và Y là hai hợp chất hữu cơ chứa C, H, O và chỉ có một loại nhóm chức. Khi tác dụng với dung dịch AgNO3 trong NH3 dư thì từ 1 mol hỗn hợp X và Y tạo ra 4 mol Ag. Mặt khác khi đốt cháy X và Y thì tỉ lệ số mol O2 phản ứng và số mol CO2; H2O hình thành như sau:
- Với X: n C O 2 : n H 2 O = 1 : 1
- Với Y: n O 2 : n C O 2 : n H 2 O = 3 : 4 : 2
Công thức cấu tạo của X và Y là:
A. HCHO và CH3CHO
B. HCHO và CH2(CHO)2
C. HCHOvà (CHO)2
D. (CHO)2 và CH2(CHO)2
Đáp án C
1 mol hỗn hợp X, Y phản ứng tráng bạc tạo thành 4 mol Ag
=> X và Y có một chất là HCHO, một chất là anđehit 2 chức hoặc cả 2 chất đều là anđehit 2 chức
Với X ta có: n H 2 O = n C O 2
=>x là anđehit no, đơn chức, mạch hở =>x là HCHO
=>Y là anđehit 2 chức. Gọi CT của Y là CxHyO2
Giả sử đốt cháy 1 mol Y ta thu được
x m o l C O 2 ; y 2 m o l H 2 O ⇒ n O 2 p h ả n ứ n g = x - 1 + y 4 ⇒ n O 2 : n C O 2 : n H 2 O = 3 : 4 : 2 = ( x - 1 + y 4 ) : x : y 2 ⇒ x = y = 2
Vậy Y là (CHO)2
Đúng 0
Bình luận (0)
Cao su buna-N được tạo ra do phản ứng đồng trùng hợp giữa buta-1,3-đien với acrilonitrin. Đốt cháy hoàn toàn một lượng cao su buna-N với không khí vừa đủ (chứa 80% N2 và 20% O2 về thể tích), sau đó đưa hỗn hợp sau phản ứng về 136,5oC thu được hỗn hợp khí và hơi Y (chứa 14,41% CO2 về thể tích). Tỷ lệ số mắt xích giữa buta-1,3-đien và acrilonitrin là A. 2:1 B. 3:2 C. 1:2 D. 2:3
Đọc tiếp
Cao su buna-N được tạo ra do phản ứng đồng trùng hợp giữa buta-1,3-đien với acrilonitrin. Đốt cháy hoàn toàn một lượng cao su buna-N với không khí vừa đủ (chứa 80% N2 và 20% O2 về thể tích), sau đó đưa hỗn hợp sau phản ứng về 136,5oC thu được hỗn hợp khí và hơi Y (chứa 14,41% CO2 về thể tích). Tỷ lệ số mắt xích giữa buta-1,3-đien và acrilonitrin là
A. 2:1
B. 3:2
C. 1:2
D. 2:3
phải trộn hỗn hợp C2H2 và O2 với tỉ lệ nào về thể tích thì phản ứng cháy sẽ tạo ra nhiệt độ cao nhất? phản ứng này được ứng dụng để làm gì ?