“Độ tan của khí clo ở 5 ° C và áp suất 2 atm là 2 gam” được kí hiệu là
A. S C l ( 5 ° C , 2 a t m ) = 2 g a m
B. S C l 2 ( 5 ° C ) = 2 g a m
C. S C l ( 5 ° C , 2 a t m ) = 20 g a m
D. S C l 2 ( 5 ° C , 2 a t m ) = 2 g a m
Một săm xe máy được bơm căng không khí ở nhiệt độ 20 ° C và áp suất 2 atm. Coi sự tăng thể tích của săm là không đáng kể và biết săm chỉ chịu được áp suất tối đa là 2,5 atm. Săm sẽ bị nổ khi để ngoài nắng có nhiệt độ là
A. trên 45 ° C. B. dưới 45 ° C. C. trên 93 ° C. D. dưới 46 ° C.
Bài 4: Một săm xe máy được bơm căng không khí ở nhiệt độ 20°C và áp suất 2 atm. Hỏi săm có bị nổkhông khi đề ngoài nắng nhiệt độ 42°C ? Coi sự tăng thể tích của săm là không đáng kề và biết săm chịu được áp suất tối đa là 2,5 atm.
\(T_1=20^oC=293K\)
\(T_2=42^oC=315K\)
Áp suất săm xe khi để ở nhiệt độ \(42^oC\). Quá trình đẳng tích:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow\dfrac{2}{293}=\dfrac{p_2}{315}\)
\(\Rightarrow p_2=2,15atm< p_{max}=2,5atm\)
Vậy săm xe không bị nổ.
Ở nhiệt đố 00C và áp suất 1 atm, khối lượng riêng của một khối khí là 2 kg/m3. Hỏi khối khí đó ở nhiệt độ 270C và áp suất 2,5 atm thì khối lượng riêng của khí đó là bao nhiêu?
3. Một binh kín chứa khí lí tưởng ở áp suất 5 atm và nhiệt độ 37°C. Tính áp suất của khi khi nhiệt độ trong bình là 17"C..
Ta có: \(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow\dfrac{5}{37+273}=\dfrac{p_2}{17+273}\)
\(\Rightarrow p_2=4,68atm\)
Một lượng khí đựng trong một xilanh có pit tông chuyển động được. Lúc đầu, khí có thể tích 15 lít, nhiệt độ 27 ° C và áp suất 2 atm. Khi pit tông nén khí đến thể tích 12 lít thì áp suất khí tăng lên tới 3,5 atm. Nhiệt độ của khí trong pit tông lúc này là
A. 37,8 ° C
B. 147 ° C
C. 147 K
D. 47,5 ° C
Đáp án B.
Ta có: Trạng thái đầu: V 1 = 15 lít; p 1 = 2 atm; T 1 = 27 + 273 = 300 K.
Trạng thái sau: V 2 = 12 lít; p 2 = 3,5 atm; T 2 = ?
Áp dụng phương trình trang thái ta được:
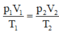
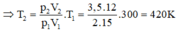
Suy ra t 2 = 420 – 273 = 147 ° C
Một khối khí trong xilanh lúc đầu có hai áp suất 2 atm nhiệt độ 27°c và thể tích 150 cm³ khi pittông nén khí đến 50 cm³ và áp suất 10 atm thì nhiệt độ cuối cùng của khối khí là bao nhiêu
P1=2atm
T1=27+273=300k
V1=150cm3=0,15l
P2=10atm
V2=50cm3=0,05l
T2=? K
Giai
P1.V1/T1=P2.V2/T2
2.0,15/300=10.0,05/T2
=> T2= 500K
Cho một khối khí ở nhiệt độ phòng (300C), có thể tích 0,5m3 và áp suất 1 atm. Người ta nén khối khí trong bình tới áp suất 2 atm. Biết rằng nhiệt độ của khối khí được giữ không đổi trong suốt quá trình nén, thể tích khối khí sau khi nén là:
A. 0,25m3
B. 1 m3
C. 0,75m3
D. 2,5m3
Đáp án A
Vì nhiệt độ của khối khí được giữ không đổi trong suốt quá trình nén, nên theo định thức bôi-lơ-ma-ri-ốt ta có:
![]()
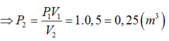
Trong bình kín chứa 2,24 lít khí Cl 2 (đktc). Cho a gam P vào bình rồi nung nóng thu được 2 muối PCl 3 và PCl 5 có tỉ lệ mol 1 : 2 hạ nhiệt độ trong bình về 0 ° C , áp suất khí trong bình giảm còn 0,35 atm. Giá trị của a là
A. 1,55.
B. 1,86.
C. 0,93.
D. 1,24.
trong bình kín chứa 2,24 lít khí C l 2 (đktc). Cho a gam P vào bình rồi nung nóng thu được 2 muối P C l 3 v à P C l 5 có tỉ lệ mol 1 : 2 hạ nhiệt độ trong bình về 0 ° C , áp suất khí trong bình giảm còn 0,35 atm. Giá trị của a là
A. 1,55.
B. 1,86.
C. 0,93.
D. 1,24.