Dung dịch muối đồng (II) sunfat (CuS O 4 ) có thể phản ứng với dãy chất
A. C O 2 , NaOH, H 2 S O 4 , Fe
B. H 2 S O 4 , AgN O 3 , Ca(OH ) 2 , Al
C. NaOH, BaC l 2 , Fe, H 2 S O 4
D. NaOH, BaC l 2 , Fe, Al
Trộn 200 gam dung dịch một muối sunfat của kim loại kiềm nồng độ 13,2% với 200 gam dung dịch NaHCO3 4,2% sau phản ứng thu được m gam dung dịch A (m < 400 gam). Cho 200 gam dung dịch BaCl2 20,8% vào dung dịch A sau phản ứng còn dư muối sunfat. Thêm tiếp 40 gam dung dịch BaCl2 20,8%, dung dịch thu được còn dư BaCl2. Biết các phản ứng xảy ra hoàn toàn.
a) Xác định công thức muối sunfat của kim loại kiềm ban đầu.
b) Tính nồng độ % của các chất tan trong dung dịch A.
c) Dung dịch muối sunfat của kim loại kiềm ban đầu có thể tác dụng được với các chất nào sau đây: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Ag, Fe, CuS, Fe(NO3)2? Viết phương trình hóa học của các phản ứng xảy ra.
a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
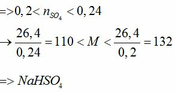
b)
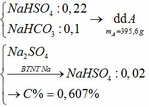
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O
Câu 1: Muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
A. CO2, NaOH, H2SO4,Fe B. H2SO4, AgNO3, Ca(OH)2, Al
C. NaOH, BaCl2, Fe, H2SO4 D. NaOH, BaCl2, Fe, Al
Câu2: Oxit bazơ nào sau đây được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm?
CuO B. ZnO C. CaO D. PbO
Câu 3: Dãy oxit tác dụng với dung dịch axit clohiđric (HCl):
A. CuO, Fe2O3, CO2, FeO.
B. Fe2O3, CuO, MnO, Al2O3.
C. CaO, CO, N2O5, ZnO.
D. SO2, MgO, CO2, Ag2O.
Câu 4: Dãy oxit tác dụng với dung dịch NaOH:
A.CuO, Fe2O3, SO2, CO2.
B. CaO, CuO, CO, N2O5.
C. CO2, SO2, P2O5, SO3.
D. SO2, MgO, CuO, Ag2O.
Câu 5: Dãy oxit vừa tác dụng nước, vừa tác dụng với dung dịch kiềm là:
A.CuO, Fe2O3, SO2, CO2.
B. CaO, CuO, CO, N2O5.
C. SO2, MgO, CuO, Ag2O.
D. CO2, SO2, P2O5, SO3.
Câu 6: Dãy oxit vừa tác dụng với nước, vừa tác dụng với dung dịch axit là:
A.CuO, Fe2O3, SO2, CO2.
B. CaO, CuO, CO, N2O5.
C. CaO, Na2O, K2O, BaO.
D. SO2, MgO, CuO, Ag2O.
Câu 7: Dãy oxit vừa tác dụng với axit, vừa tác dụng với kiềm là:
A. Al2O3, ZnO, PbO2, Cr2O3.
B. Al2O3, MgO, PbO, SnO2.
C. CaO, FeO, Na2O, Cr2O3.
D. CuO, Al2O3, K2O, SnO2.
Câu 8: Dãy oxit tác dụng với dung dịch H2SO4 loãng là:
A. MgO, Fe2O3, SO2, CuO.
B. Fe2O3, MgO, P2O5, K2O .
C. MgO, Fe2O3, CuO, K2O.
D. MgO, Fe2O3, SO2, P2O5.
Câu 9: Sản phẩm của phản ứng phân huỷ Fe(OH)3 bởi nhiệt là :
A. FeO và H2O B. FeO và H2 C. Fe2O3 và H2 D. Fe2O3 và H2O
Câu 10:Dung dịch KOH phản ứng với dãy oxit:
A.. CO2; SO2; P2O5; Fe2O3 B. Fe2O3; SO2; SO3; MgO
C. P2O5; CO2; Al2O3 ; SO3 D. P2O5 ; CO2; CuO; SO3
Câu 11: Dãy các hidroxit bị nhiệt phân huỷ tạo thành oxit tương ứng và nước:
A. Cu(OH)2 ; Zn(OH)2; Al(OH)3; Mg(OH)2
B. Cu(OH)2 ; Zn(OH)2; Al(OH)3; NaOH
C. Fe(OH)3; Cu(OH)2; KOH; Mg(OH)2
D. Fe(OH)3; Cu(OH)2; Ba(OH)2; Mg(OH)2
Câu 12: Có thể tinh chế CO ra khỏi hỗn hợp (CO + CO2) bằng cách:
A. Dẫn hỗn hợp qua dung dịch Ca(OH)2 dư.
B. Dẫn hỗn hợp qua dung dịch PbCl2 dư
C. Dẫn hỗn hợp qua NH3.
D. Dẫn hỗn hợp qua dung dịch Cu(NO3)2.
Câu 13: MgCO3 tác dụng với dung dịch HCl sinh ra:
A. Chất khí cháy được trong không khí
B. Chất khí làm vẫn đục nước vôi trong.
C. Chất khí duy trì sự cháy và sự sống.
D. Chất khí không tan trong nước.
Câu 14: Kẽm tác dụng với dung dịch axit clohiđric sinh ra:
A. Dung dịch có màu xanh lam và chất khí màu nâu.
B. Dung dịch không màu và chất khí có mùi hắc.
C. Dung dịch có màu vàng nâu và chất khí không màu
D. Dung dịch không màu và chất khí cháy được trong không khí.
Câu 15: Chất phản ứng được với dung dịch HCl tạo ra một chất khí có mùi hắc, nặng hơn không khí và làm đục nước vôi trong:
A. Zn B. Na2SO3 C. FeS D. Na2CO3
Câu 16: Dãy các chất không tác dụng được với dung dịch HCl là:
A. Al, Fe, Pb.
B. Al2O3, Fe2O3, Na2O.
C. Al(OH)3, Fe(OH)3, Cu(OH)2.
D. BaCl2, Na2SO4, CuSO4.
Câu 17: Phân đạm cung cấp nguyên tố nào cho cây trồng?
A. Phopho B. Kali C. Nitơ D. Cả 3 nguyên tố N, P, K
Câu 18: CuO tác dụng với dung dịch H2SO4 tạo thành:
A. Dung dịch không màu.
B Dung dịch có màu lục nhạt.
C. Dung dịch có màu xanh lam.
D. Dung dịch có màu vàng nâu.
Câu 19: Khi cho từ từ dung dịch NaOH cho đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm HCl có nhỏ vài giọt phenolphtalein. Hiện tượng quan sát được trong ống nghiệm là:
A. Màu đỏ mất dần.
B. Không có sự thay đổi màu
C. Màu đỏ từ từ xuất hiện.
D. Màu xanh từ từ xuất hiện.
Câu 20: Cho một mẩu giấy quỳ tím vào dung dịch NaOH. Thêm từ từ dung dịch HCl vào cho đến dư ta thấy màu giấy quì:
A. Màu đỏ không thay đổi
B. Màu đỏ chuyển dần sang xanh.
C. Màu xanh không thay đổi
D. Màu xanh chuyển dần sang đỏ.
Câu 21: Cho 300ml dung dịch HCl 1M vào 300ml dung dịch NaOH 0,5M. Nếu cho quì tím vào dung dịch sau phản ứng thì quì tím chuyển sang:
A. Màu xanh.
B. Không đổi màu.
C. Màu đỏ.
D. Màu vàng nhạt.
Câu 22: Trung hòa 200 ml dung dịch H2SO4 1M bằng 200 gam dung dịch NaOH 10%. Dung dịch sau phản ứng làm quì tím chuyển sang:
A. Đỏ
B. Vàng nhạt
C. Xanh
D. Không màu
Câu 23: Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit là:
A. CaCO3 và HCl B. Na2SO3 và H2SO4 C. CuCl2 và KOH D. K2CO3 và HNO3
Câu 24: Cho phản ứng: Cho các chất CaCO3, HCl, NaOH, BaCl2, CuSO4, có bao nhiêu cặp chất có thể phản ứng với nhau ?
A. 2 B. 4 C. 3 D. 5
Câu 25: Sơ đồ phản ứng nào sau đây dùng để sản xuất axit sunfuric trong công nghiệp ?
A. Cu SO2
SO3
H2SO4 . B. Fe
SO2
SO3
H2SO4.
C. FeO SO2
SO3
H2SO4. D. FeS2
SO2
SO3
H2SO4.
Câu 26: Cặp chất tác dụng với dung dịch axit clohiđric:
A. NaOH, BaCl2 . B. NaOH, BaCO3.
C. NaOH, Ba(NO3)2. D. NaOH, BaSO4.
Câu 27: Để phân biệt 3 ống nghiệm chứa dung dịch HCl, dung dịch H2SO4 và nước ta dùng:
A. Quì tím, dung dịch NaCl . B. Quì tím, dung dịch NaNO3.
C. Quì tím, dung dịch Na2SO4. D. Quì tím, dung dịch BaCl2.
Câu 28: Có 3 oxit màu trắng: MgO, Al2O3, Na2O. Có thể phân biệt được các chất đó bằng thuốc thử sau:
A. Chỉ dùng quì tím. B. Chỉ dùng axit
C. Chỉ dùng phenolphtalein D. Dùng nước
Câu 29: Để phân biệt dd KOH và dd Ba(OH)2 ta dùng thuốc thử là:
A. Phenolphtalein B. Quỳ tím
C. dd H2SO4 D. dd HCl
Câu 30: Thuốc thử dùng để phân biệt 4 chất: HNO3, Ba(OH)2, NaCl, NaNO3 đựng riêng biệt trong các lọ mất nhãn là:
A. Dùng quì tím và dung dịch Ba(NO3)2.
B. Dùng dung dịch phenolphtalein và dung dịch AgNO3.
C. Dùng quì tím và dung dịch AgNO3 .
D. Dùng dung dịch phenolphtalein và dung dịch Ba(NO3)2.
Câu 31: Màng trắng trên bề mặt dung dịch nước vôi trong là sản phẩm của phản ứng giữa cặp chất nào sau đây?
A. CO2 và H2O | B. CaO và H2O |
C. CO2 và Ca(OH)2 | D. CaO và CO2 |
Câu 32: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh. B. Có khí thoát ra.
C. Có kết tủa đỏ nâu. D. Kết tủa màu trắng.
Câu 33: Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Muối NaCl B. Nước vôi trong C. Dung dịch HCl D. Dung dịch NaNO3
Câu 34: NaOH rắn có khả năng hút nước rất mạnh nên có thể dùng làm khô một số chất. NaOH làm khô khí ẩm nào sau đây?
A. H2S. B. H2. C. CO2. D. SO2.
Câu 35: Hòa tan hết 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là :
A. 50 gam B. 40 gam C. 60 gam D. 73 gam
Câu 36: Oxit của một nguyên tố hóa trị (II) chứa 28,57% oxi về khối lượng . Nguyên tố đó là:
A. Ca B. Mg C. Fe D. Cu
Câu 37: Hòa tan 2,4 gam oxit của một kim loại hóa trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
A. CuO B. CaO C. MgO D. FeO
Câu 38: Cho 20 gam hỗn hợp X gồm CuO và Fe2O3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và Fe2O3 trong hỗn hợp X lần lượt là :
A. 25% và 75% B. 20% và 80% C. 22% và 78% D. 30% và 70%
Câu 39: Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là :
A. 19,7 g B. 19,5 g C. 19,3 g D. 19 g
Câu 40: Khí có tỉ khối đối với hiđro bằng 32 là:
A. N2O B. SO2 C. SO3 D. CO2
Câu 41: Hòa tan 12,6 gam natrisunfit vào dung dịch axit clohidric dư. Thể tích khí SO2 thu được ở đktc là:
A. 2,24 lít B. 3,36 lit C. 1,12 lít D. 4,48 lít
Câu 42: Hòa tan hoàn toàn 8 gam Fe2O3 bằng dung dịch H2SO4 loãng thu được dung dịch A. Cho dung dịch NaOH dư vào A, lọc kết tủa nung trong không khí đến khối lượng không đổi thu được m gam chất rắn, giá trị của m là:
A. 8 gam B. 10 gam C. 12 gam D. 16 gam
Câu 43: Nhiệt phân hoàn toàn 19,6g Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là:
A. 6,4 g B. 9,6 g C. 12,8 g D. 16 g
Câu 44: Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 g B. 16,475 g C. 17,475 g
Dãy A gồm các dung dịch : NaOH, HCl, H 2 S O 4 ; Dãy B gồm các dung dịch: CuS O 4 , BaC l 2 , AgN O 3 . Cho lần lượt các chất ở dãy A phản ứng đôi một với các chất ở dãy B. Số phản ứng thu xảy ra thu được kết tủa là:
A. 4
B. 5
C. 6
D. 3
Cho 3.25g kẽm tác dụng vừa đủ với dung dịch axit sunfuric, sau phản ứng thu được khí hidro và dung dịch muối kẽm sunfat
a) Tính thể tích khí hidro sinh ra (ở đktc)
b) Dẫn toàn bộ khí hidro sinh ra ở trên đi qua 4,8g bột đồng (II) oxit đun nóng. Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
ta có phương trình :
Zn + H2SO4➞ ZnSO4 +H2
1 1 1 1
0,05 0,05 0,05 0,05
\(n_{Zn}\)=\(\frac{m}{M}\) =\(\frac{3,25}{65}\)=0,05 (mol)
vì H2 có cùng tỉ lệ với Zn nên số mol của H2 cũng = 0,05 mol
\(V_{H_2}\)= n . 22.4 =0,05.22,4=1,12(l) (đktc)
b/ H2 + CuO ➞ Cu +H2O
1 1 1 1
0,05 0,06
0,05 0,05
Theo đề bài thì thể tích khí hidro sinh ra là 1,12 l và khối lượng bột Đồng (II) oxit là 4,8
nCuO= \(\frac{m}{M}\)=\(\frac{4,8}{80}\)=0,06 (mol)
So sánh
\(n_{H_2}\)= \(\frac{0,05}{1}\)=0,05 < \(n_{CuO}\)= \(\frac{0,06}{1}=0,06\)
➞ CuO dư
➞ nCuO tham gia là 0,05 (mol)
➞ nCuO dư =\(0,06-0,05=0,01\left(mol\right)\)
➞ mCuO dư = nCuO dư . M = \(0,01.80=0,8\left(g\right)\)
Vậy sau phản ứng CuO dư và dư 0,8 (g)
nZn= 3.25/65=0.05 mol
Zn + H2SO4 --> ZnSO4 + H2
0.05__________________0.05
VH2= 0.05*22.4=1.12l
nCuO= 4.8/80=0.06 mol
CuO + H2 -to-> Cu + H2O
1______1
0.06____0.05
Lập tỉ lệ: 0.06/1 > 0.05/1 => CuO dư, H2 hết
nCuO dư= 0.06-0.05=0.01 mol
mCuO dư= 0.01*80=0.8g
Bài 1: Cho các dung dịch : đồng (II) sunfat, sắt (II) sunfat, Magie sunfat, bạc nitrat và các kim loại: Cu,Fe,Mg,Ag .Theo em những cặp chất nào (kim loại và muối ) phản ứng được với nhau?viết PTHH
Bài 2: Bạc có lẫn sắt và kẽm.Làm thế nào để thu được bạc tinh khiết?
Bài 3: Dung dịch kẽm suntat có lẫn tạp chất là đồng (II)sunfat. Dùng kim loại nào để làm sạch muối kẽm sunfat?giải thích và viết PTHH
Bài 2. Để thu được bạc tinh khiết ta cho hỗn hợp trên vào dung dịch AgNO3 , chất rắn sau phản ứng là bạc tinh khiết
\(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\\ Fe+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2Ag\)
Bài 3. Dùng kim loại kẽm để làm sạch muối kẽm sunfat do kẽm tác dụng được với CuSO4, tạo thành dung dịch ZnSO4 và kim loại đồng
\(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
Để kết tủa hoàn toàn dung dịch có chứa 20 gam đồng (II) sunfat (CuS * O_{4}) cần vừa đủ 200 mà dung dịch natri hidroxit (NaOH) chưa biết nồng độ. a) Tính nồng độ mol/lít dung dịch NaOH đã dùng. b) Tinh khối lượng kết tủa sinh ra. c) . Nung kết tủa đến khi phản ứng hoàn toàn được m gam chất rắn. Tim m?
\(n_{CuSO_4}=\dfrac{20}{160}=0,125(mol)\\ a,CuSO_4+2NaOH\to Cu(OH)_2\downarrow+2NaCl\\ \Rightarrow n_{NaOH}=0,25(mol)\\ \Rightarrow C_{M_{NaOH}}=\dfrac{0,25}{0,2}=1,25M\\ b,n_{Cu(OH)_2}=0,125(mol)\\ \Rightarrow m_{Cu(OH)_2}=0,125.98=12,25(g)\\ c,Cu(OH)_2\xrightarrow{t^o}CuO+H_2O\\ \Rightarrow n_{CuO}=0,125(mol)\\ \Rightarrow m_{CuO}=0,125.80=10(g)\)
Câu1: hòa tan 0,24 g một kim loại hóa trị II bằng 100 ml dung dịch H2SO4 0,2M để trung hòa lượng axit dư trong dung dịch sau phản ứng phải dùng 80 ml dung dịch NaOH 0,25M. xác định tên Kim loại?
Câu 2: một nguyên tố kim loại M có hóa trị III trong hỗn hợp chất muối sunfat. biết rằng 34,2 g muối sunfat của kim loại M phản ứng vừa đủ với dung dịch NaOH tạo ra được 15,6 gam kết tủa. Tìm tên kim loại M?
Giúp tớ với!!
1.
n H2SO4 = 0,1.0,2 = 0,02 (mol)
n NaOH = 0,08.0,25=0,02 (mol)
R + H2SO4 ----> RSO4 + H2
0,01___(0,02 - 0,01)
2NaOH + H2SO4 ----> Na2SO4 + 2H2O
0,02________0,01
M R = 0,24/0,01 = 24(g) => Magie_Mg
2.
CTTQ: R2(SO4)3
\(n_{\text{R2(SO4)3}}=\frac{34,2}{2R+288}\left(mol\right)\)
\(n_{\text{R(OH)3}}=\frac{15,6}{R+51}\left(mol\right)\)
R2(SO4)3 + 6NaOH ----> 3Na2SO4 + 2R(OH)3
\(\frac{34,2}{2R+288}\)_______________________________\(\frac{34,2}{R+144}\)
=> \(\frac{34,2}{R+144}=\frac{15,6}{R+51}\Leftrightarrow34,2R+1744,2=15,6R+2246,4\)
\(\Leftrightarrow18,6R=502,2\Leftrightarrow R=27\) => R là kim loại nhôm_Al
Ngâm m gam bột kim loại A(hoá trị II) vào dung dịch đồng II sunfat dư. Sau phản ứng, thu được lượng chất rắn nặng (m-0,04)gam. Nếu ngâm m gam bột kim loại A như trên vào dung dịch bạc natri dư, sau khi phản ứng kết thúc, khối lượng chất rắn thu được tăng 6,08g so với khối lượng chất rắn thu được khi ngâm kim loại vào dung dịch
CuSO4 . Tìm tên kim loại A và tính m
5. Ngâm bột sắt dư trong 10 ml dung dịch đồng sunfat 1M . Sau khi phản ứng kết thúc , lọc được chất rắn A và dung dịch B .
a) Cho A tác dụng với dung dịch HCL dư . Tính khối lượng chất rắn còn lại sau phản ứng .
b) Tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B
giải nhanh giúp mk vớiiiiii ạ
\(n_{CuSO_4}=1.0,01=0,01(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\)
Do Cu ko td với HCl nên chất rắn sau phản ứng vẫn là Cu
\(n_{Cu}=n_{Fe}=0,01(mol)\\ \Rightarrow m_{Cu}=0,01.64=0,64(g)\\ b,PTHH:FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{NaOH}=2n_{FeSO_4}=2n_{Fe}=0,02(mol)\\ \Rightarrow V_{dd_{NaOH}}=0,02.1=0,02(l)\)
a) Đổi 10ml = 0,01l
nCuSO4 = V. CM = 0,01 . 1 = 0,01 mol
PTHH : Fe + CuSO4 -> Fe SO4 + Cu
PT : 1 1 1 1
Đề: 0,01 0,01
mCu = n . M = 0,01 . 64 = 0,64 g
b) PTHH : FeSO4 + 2NaOH -> Fe(OH)2 + NaSO4
PT : 1 2 1 1
Đề: 0,01 0,02
VNaOH = \(\dfrac{n}{CM}\) = \(\dfrac{0,02}{1}\) = 0,02l = 20ml