Cho 1,08 gam kim loại Z vào dung dịch H 2 S O 4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Vậy kim loại Z là:
A. Niken
B. Canxi
C. Nhôm
D. Sắt
Cho 1,08 gam kim loại R vào dung dịch H 2 SO 4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
A. Niken
B. Canxi
C. Nhôm
D. Sắt
Cho 2,16 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 13,68 gam một muối khan duy nhất. Tìm công thức hóa học của kim loại R. bao nhiêu?
Đặt hóa trị R là \(n(n\in \mathbb{N^*})\)
\(2R+nH_2SO_4\to R_2(SO_4)_n+nH_2\\ \Rightarrow n_R=2n_{R_2(SO_4)_n}\\ \Rightarrow \dfrac{2,16}{M_R}=\dfrac{27,36}{2M_R+96n}\\ \Rightarrow 27,36M_R=4,32M_R+207,36n\\ \Rightarrow M_R=9n\)
Thay \(n=3\Rightarrow M_R=27(g/mol)\)
Vậy R là nhôm (Al)
Cho 0,15 mol hỗn hợp rắn X gồm Mg và Fe vào dung dịch chứa FeCl3 0,8M và CuCl2 0,6M thu được dung dịch Y và 7,52 gam rắn gồm hai kim loại. Cho dung dịch AgNO3 dư vào Y, thu được 29,07 gam kết tủa. Nếu cho 0,15 mol X trên vào dung dịch HNO3 loãng dư, thấy khí NO thoát ra; đồngthời thu được dung dịch Z có khối lượng tăng 4,98 gam so với dung dịch ban đầu. Cô cạn dung dịch Z thu được lượng muối khan là
A. 32,26 gam
B. 33,86 gam
C. 30,24 gam
D. 33,06 gam
Cho kim loại M vào dung dịch HNO3 loãng dư, thu được dung dịch X có khối lượng tăng 9,02 gam so với dung dịch ban đầu và giải phóng ra 0,025 mol khí N2. Cô cạn dung dịch X thu được 65,54 gam muối khan. Kim loại M là
A. Ca.
B. Zn
C. Al.
D. Mg
Đáp án D
Gọi kim loại M có hóa trị n
Ta có:
mKim loại M = mTăng + mN2 = 9,72 gam.
+ Đặt nNH4NO3 = a ta có p.tr theo muối là:
mMuối = mKim loại + mNO3/Muối kim loại + mNH4NO3.
65,54 = 9,72 + (0,025×10 + 8a)62 + 80a
Û nNH4NO3 = a = 0,07
+ Bảo toàn e ta có:
M = 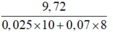 × n = 12n
× n = 12n
⇒ M = 24 ≡ Mg ứng với n = 2
Cho kim loại M vào dung dịch HNO3 loãng dư, thu được dung dịch X có khối lượng tăng 9,02 gam so với dung dịch ban đầu và giải phóng ra 0,025 mol khí N2. Cô cạn dung dịch X thu được 65,54 gam muối khan. Kim loại M là
A. Ca.
B. Zn.
C. Al.
D. Mg.
Đáp án D
Gọi kim loại M có hóa trị n
Ta có
mKim loại M = mTăng + mN2 = 9,72 gam.
+ Đặt nNH4NO3 = a ta có phương trình theo muối là:
mMuối = mKim loại + mNO3/Muối kim loại + mNH4NO3.
65,54 = 9,72 + (0,025×10 + 8a)×62 + 80a
⇔ nNH4NO3 = a = 0,07
+ Bảo toàn e ta có:
M = ![]() × n = 12n
× n = 12n
⇒ M = 24 ≡ Mg ứng với n = 2
Cho 18,4 gam hỗn hợp kim loại Fe, Mg vào dung dịch H 2 SO 4 loãng, dư thu được 11,2
lít H 2 (đktc) và dung dịch A. Cho NaOH dư vào dung dịch A thu được kết tủa B. Lọc và nung B
trong không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
Theo gt ta có: $n_{H_2}=0,5(mol)$
Gọi số mol Fe và Mg lần lượt là a;b(mol)
$\Rightarrow 56a+24b=18,4(g)$
Bảo toàn e ta có: $2a+2b=1$
Giải hệ ta được $a=0,2;b=0,3$
$\Rightarrow m=28(g)$
Cho 18,9 gam bột nhôm vào dung dịch X chứa hai muối Cu(NO3)2 và AgNO3 sau khi phản ứng hoàn toàn thu được 69,3 gam hỗn hợp chất rắn Y và dung dịch Z. Biết rằng dung dịch Z không thể hòa tan được sắt kim loại. Lọc chất rắn rồi cho lượng dư dung dịch NH3 vào dung dịch X thì thu được 31,2 gam gam kết tủa. Nếu cô cạn dung dịch X rồi nung đến khối lượng không đổi thì thu được m gam rắn T. Giá trị của m là:
A. 68,4
B. 61,2
C. 98,4
D. 105,6
Nhúng một lá kim loại M (chỉ có hoá trị hai trong hợp chất) có khối lượng 50 gam vào 200 ml dung dịch AgNO3 1M cho đến khi phản ứng xảy ra hoàn toàn. Lọc dung dịch, đem cô cạn thu được 18,8 gam muối khan. Kim loại M là
A. Mg
B. Cu
C. Zn
D. Fe
Bài 6: Cho 1,74 gam hỗn hợp gồm 3 kim loại: nhôm , đồng, sắt vào dung dịch axit clohidric (lấy dư) , sau khi phản ứng hoàn toàn thu được dung dịch A và m gam chất rắn B .Cô cạn dung dịch A thu được 3,94 gam muối khan . Đem chất rắn B nung trong không khí đến khối lượng không đổi thì được chất rắn B khối lượng (m+ 16) gam. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Cứu
Chất rắn B là Cu
mCu tăng= 0,16g= mO
=> nO= 0,16/16= 0,01 mol
Cu+ O -> CuO
=> nCu= 0,01 mol
=> mCu= 0,01.64= 0,64g
mFe,Al= 1,74-0,64= 1,1g
2Al+ 6HCl -> 2AlCl3+ 3H2
Fe+ 2HCl -> FeCl2+ H2
Đặt x là mol Al; y là mol Fe
Ta có hệ: 27x+ 56y= 1,1 và 133,5x+ 127y= 3,94
<=> x=0,02; y=0,01
=> mAl= 0,02.27= 0,54g
mCu= 0,01.64=0,64g
=> mFe=0,01.56=0,56 g
Mình nghĩ là đề bài p có Cu vì HCl lấy dư mà lúc tác dụng kloa mà vẫn còn có chất rắn ?