lập CTHH của các hợp chất sau:cu(2)vàO ;Al(3)và SO4(2)
Lập CTHH của 1 chất biết khối lượng phân tử hợp chất là 142. thành phần khối lượng của các nguyên tố là 32,39% Na, 22,54% S, 45,07% O.
Tìm số mol mỗi chất
- Na: 142x32,39%/23= 2 mol
- S: 142x22,54%/32 = 1 mol
- O: 142x45,07%/16=4 mol
Tỉ lệ mol:
Na:S:O=2:1:4
===> công thức cần tìm là Na2SO4
gọi công thức hóa học là : NaxSyOy
theo đề ta có : x:y:z=\(\frac{32,39}{23}:\frac{22,54}{32}:\frac{45,07}{16}\)=1:1:3
vậy công thức hóa học là :NaSO3
Lập công thức hoá học của các hợp chất theo hoá trị
a, Ba (II) và SO4 (II)
b, Na (I) và S (II)
Mong mọi người giúp đỡ
Phân hủy hợp chất A thu được 7,45g hợp chất B và 3,36l khí oxi . Trong B có 52,35%k ;47,65%cl Xác định CTHH của B và A biết CTHH trùng với CTĐGN
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\Rightarrow n_O=2n_{O_2}=0,3\left(mol\right)\)
\(\left\{{}\begin{matrix}m_K=7,45.52,35\%=3,9\left(g\right)\\m_{Cl}=7,45-3,9=3,55\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\\n_{Cl}=\dfrac{3,55}{35,5}=0,1\left(mol\right)\end{matrix}\right.\)
Đặt CTHH của A là KxClyOz (x, y, z nguyên dương)
=> \(x:y:z=n_K:n_{Cl}:n_O=0,1:0,1:3=1:1:3\)
=> A có CTĐGN là KClO3
Vì A có CTPT trùng với CTĐGN nên A là KClO3
Cho 6.048 g Mg phản ứng hết với 189 g dd HNO3 40% thu được dd X ( không chứa muối) amoni và hỗn hợp hkí là oxjt của njtơ.thêm 392 g dd KOH 20% vào dd X, rồi cô cạn và nung sản phẩm đến khối lượng ko đổi thu được 118,06 g hỗn hợp chất rắn. Hãy xác định nồn độ % của các chất trong X
nMg = 0,252, nHNO3 = 1,2 & nKOH = 1,4
Vậy KOH dư, Mg2+ đã kết tủa hết, phần dung dịch chứa KNO3 & KOH dư, phần kết tủa chứa Mg(OH)2, cô cạn và nung thu được KNO2 & KOH dư & MgO
nKOH ban đầu = nKNO2 + nKOH dư = 1,4
m rắn = 85nKNO2 + 56nKOH dư + 40.0,252 = 118,06
—> nKNO2 = 1,02 & nKOH dư = 0,38
Bảo toàn N —> nN trong khí = nHNO3 – nKNO3 = 0,18
Vậy mỗi N+5 đã nhận 0,252.2/0,18 = 2,8 mol electron
—> Số oxi hóa trung bình của N = 5 – 2,8 = +2,2
—> Oxit trung bình NO1,1 (0,18 mol)
nHNO3 pư = 0,252.2 + 0,18 = 0,684
—> nHNO3 dư = 0,516
mdd = mMg + mddHNO3 – mNO1,1 = 189,36
—> C% HNO3 dư & C% Mg(NO3)2
Một hợp chất có khối lượng mol bằng 385g/mol, trong đó Zn= 50,65%; P = 16,1%, còn lại là O. Xác định CTHH của hợp chất.
\(\%_{O}=100\%-50,65\%-16,1\%=33,25\%\)
Trong 1 mol hợp chất:
\(\begin{cases} n_{Zn}=\dfrac{385.50,65\%}{65}\approx3(mol)\\ n_{P}=\dfrac{385.16,1\%}{31}\approx2(mol)\\ n_{O}=\dfrac{385.33,25\%}{16}\approx8(mol) \end{cases}\)
Do đó CTHH hợp chất là \(Zn_3(PO_4)_2\)
Một hợp chất có khối lượng mol bằng 385g/mol, trong đó Zn= 50,65%; P = 16,1%, còn lại là O. Xác định CTHH của hợp chất.
\(\%O=100-50.65-16.1=33.25\%\)
CTHH là : \(Zn_xP_yO_z\)
\(\%Zn=\dfrac{65x}{385}\cdot100\%=50.65\%\)
\(\Rightarrow x=3\)
\(\%P=\dfrac{31y}{385}\cdot100\%=16.1\%\)
\(\Rightarrow y=2\)
\(M=65\cdot3+31\cdot2+16z=385\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow z=8\)
\(CTHH:Zn_3\left(PO_4\right)_2\)
từ ghép đẳng lập
có các tiếng...............................về mặt ngữ pháp
có tính chất...................................., nghĩa của từ ghép đẳng lập................................hơn nghĩa của các tiếng tạo nên nó
Sự bình đẳng
Phân nghĩa- khái quát
Hok tốt
Từ ghép đẳng lập có các tiếng bình đẳng về mặt ngữ pháp, có tính chất hợp nghĩa, nghĩa của từ ghép đẳng lập khái quát hơn nghĩa của các tiếng tạo nên nó.
Từ ghép đẳng lập:
+ Có các tiếng bình đẳng với nhau về mặt ngữ pháp
+ Có tính chất phân nghĩa (mỗi tiếng đều có thể tách ra để tạo 1 từ khác riêng biệt), nghĩa của từ ghép đẳng lập khái quát hơn nghĩa của các tiếng tạo nên nó
Hượp chất A có phân tử gồm 1X và 3Y. Tỉ lệ khối lượng của X và Y là 2:3.Phân tử khối của hợp chất này là 80.
a,Nguyên tố X,Y là nguyên tố nào?
b,Viết CTHH của hợp chất A
(làm nhanh hộ mik nhá,mik cảm ơn nhiều)
Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1 : 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
A. 10,8
B. 5,4
C. 7,8
D. 43,2
Đáp án B
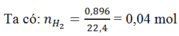
Gọi: nNa = x mol ⇒ nAl = 2x mol
Phản ứng:
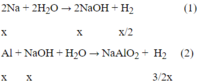
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2)
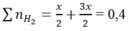
![]()
⇒mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol ⇒ nAl dư = 0,4 - 0,2 = 0,2 mol
⇒mAl = 0,2.27 = 5,4 (g)