giúp mik!!!!!
1.Tính số mol của nước(H2O) có trong 0.8 l nước ( DH2O=1g/ml)
GIÚP MIK VỚI Ạ!! MIK ĐANG CẦN GẤP Ạ!
Hòa tan hoàn toàn 3,45g Na vào 100ml nước cất (dH2O = 1g/ml), thu được dung dịch X và khí Y
a. Viết các PTHH xảy ra
b. Tính CM của chất tan trong dung dịch X
c. Tính C% của chất tan trong dung dịch X
Nước nguyên chất ở 25 ° C có nồng độ H + bằng 1. 10 - 7 mol/l. Hỏi có bao nhiêu phần trăm phân tử H 2 O phân li ra ion ở nhiệt độ này, biết rằng D H 2 O = 1 g / m l ?
1 lít nước nặng 1000 g, nên số mol nước trong 1000 g là 55,5 mol.
Cứ có 55,5 mol nước ở 25 ° C thì có 1. 10 - 7 mol phân li ra ion. Phần trăm mol nước phân li ra ion :
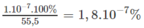
1,8. 10 - 7 % mol H 2 O phân li ra ion cũng là phần trăm số phân tử H 2 O phân li ra ion.
CHO 4,6g Na tác dụng hết với 100g nước, hãy cho biết:
a) VH2 thu được sau phản ứng (đktc)
b) Tính nồng độ % và nồng độ mol của dung dịch NaOH thu được ( DH2O =1g/ml)
Ta có : nNa \(=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH : \(2Na+2H_2O\rightarrow2NaOH+H_2\uparrow\)
a) Theo pt :\(n_{H_2}=\dfrac{1}{2}.n_{Na}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b) Theo pt : \(n_{NaOH}=n_{Na}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaOH}=0,2.40=8\left(g\right)\)
\(m_{ddspu}=4,6+100-0,1.2=104,4\left(g\right)\)
\(\Rightarrow C\%_{NaOH}=\dfrac{8}{104,4}.100\%=7,66\%\)
a, tính khối lượng oxi có trong 36ml H2O biết 1ml H2O nặng 1g. b, tính số phân tử nước? Tính số nguyên tử H có trong 36 ml H2O
\(m_{H_2O}=D\cdot V=36\cdot1=36\left(g\right)\)
\(n_{H_2O}=\dfrac{36}{18}=2\left(mol\right)\)
\(n_O=2\left(mol\right)\)
\(m_O=2\cdot16=32\left(g\right)\)
Số phân tử H2O : \(2\cdot6\cdot10^{23}=12\cdot10^{23}\left(pt\right)\)
Số nguyên tử H : \(4\cdot6\cdot10^{23}=24\cdot10^{23}\left(nt\right)\)
Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị H 1 2 trong 1ml nước (cho rằng trong nước chỉ có hai đồng vị H 1 và H 2 ). Biết rằng d H 2 O = 1 g / m l và nguyên tử khối của oxi là 16.
A. 3,01.1023.
B. 6,02.1023
C. 5,35.1020
D. 2,67.1020
Đáp án C
Gọi x là phần trăm nguyên tử của đồng vị H 1 2 ta có:
2 x + 1 ( 1 - x ) = 1 , 008 ⇒ x = 0 , 008
d = 1 g / m l ⇒ m H 2 O = 1 ⇒ n H 2 O = 1 18 ⇒ n H = 1 9 m o l
1 mol H chứa 0,008.6,02.1023 đồng vị H 1 2
⇒ 1 9 mol chứa 0 , 008 . 6 , 02 . 10 23 9 = 5 , 35 . 10 20
Trộn 156,25 gam H 2 SO 4 98% với V ml nước được dung dịch H 2 SO 4 50% (biết D H 2 O = 1 g / ml ). Giá trị của V là
A. 150.
B. 100.
C. 0,1.
D. 0,15.
Đáp án A
![]()
Pha loãng dung dịch H 2 SO 4 bằng nước, do đó khối lượng chất tan H 2 SO 4 không đổi
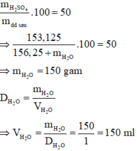
một cốc nước lọc ( H2O ) có thể tích nước là 180 ml ( d = 1g/ml) . Tính số phân tử nước có trong cốc đó .
Khối lượng của lượng nước trên bằng: 180.1 = 180 (g)
180g H2O có: \(\dfrac{180}{M_{H_2O}}=\dfrac{180}{2.1+16}=\dfrac{180}{18}=10\) (mol)
Suy ra 10 mol H2O có: 10.(6.1023) = 60.1023 phân tử H2O
cho 2,3 Na tan hết trong 47,8 ml nước thu được ddNaOH và có khí H2 thoát ra .Tính nồng độ % của dd NaOH ? Cho biết DH2O= 1g/ml