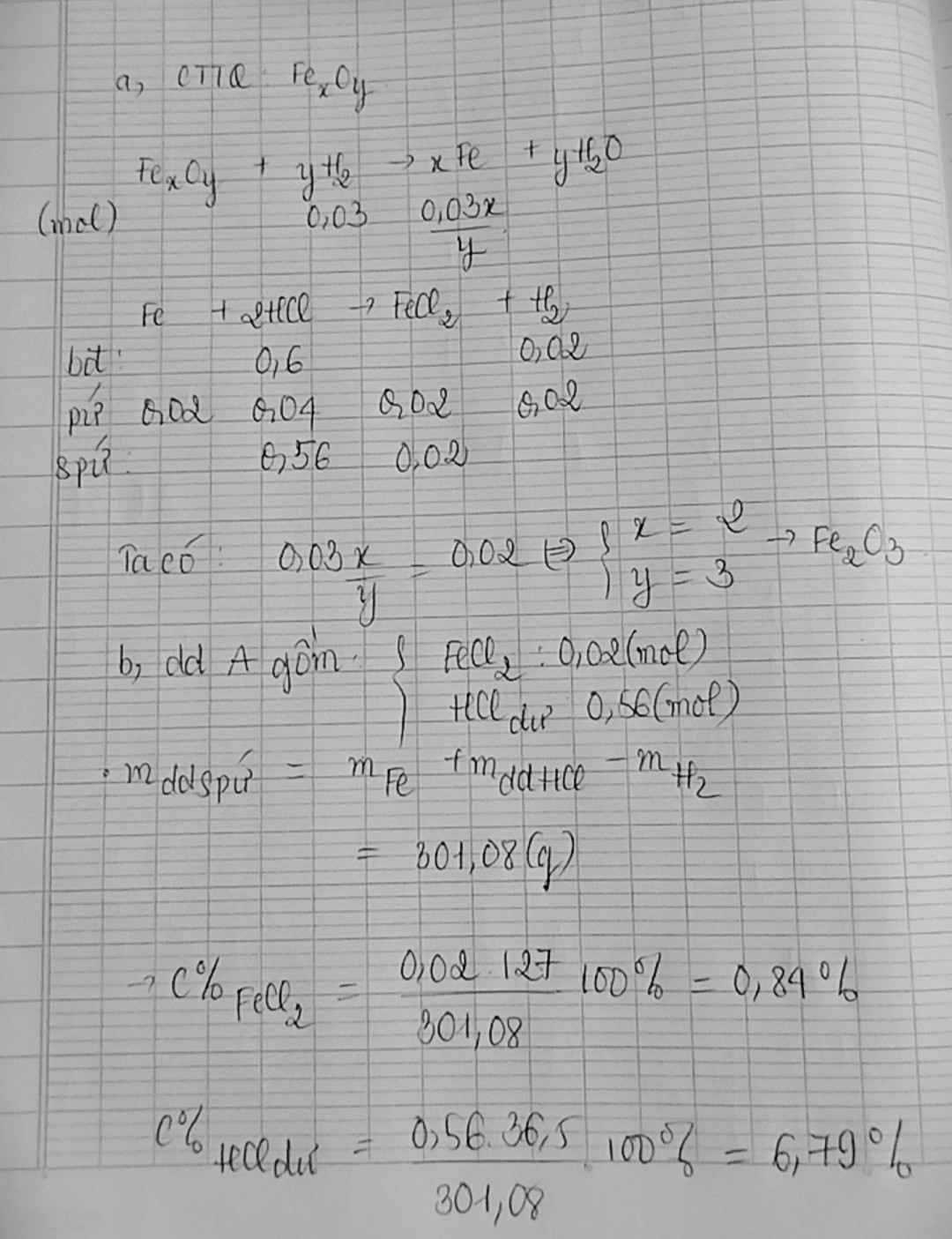Để hòa tan 3,6 gam FexOy cần dùng 0,1 l dung dịch HCL 1M. Tìm công thức của oxit sắt.

Những câu hỏi liên quan
để khử hoàn toàn m gam một oxit sắt (FexOy) phải dùng vừa đủ 0,672 lít (đktc) khí H2. Khi đem toàn bộ lượng sắt thu được hòa tan vào 300g dung dịch HCl 7,3% (dư) thì thu được 0,448 lít (đktc) khí H2 và dung dịch A.
a/ Tìm công thức hóa học của oxit sắt trên
b/ Tính nồng độ phần trăm cái chất tan trong dung dịch A
Hòa tan hoàn toàn 27,84 gam một oxit sắt cần dùng vừa đủ 480ml dung dịch H2SO4, 1M. Xác định công thức phân tử oxit sắt, tính nồng độ mol/l của dd sau phản ứng. Giả sử thể tích dung dịch khônng đáng kể.
FeOx + H2SO4 -> FeSO4 + H2O
Theo phương trình trên, ta thấy tỉ lệ mol giữa FeOx và H2SO4 là 1:1. Điều này có nghĩa là số mol FeOx trong phản ứng bằng số mol H2SO4.
Để tính số mol H2SO4, ta sử dụng công thức:
Số mol = nồng độ x thể tích
Với dung dịch H2SO4 có nồng độ 1M và thể tích 480ml, ta có:
Số mol H2SO4 = 1M x 480ml = 0.48 mol
Do đó, số mol FeOx cũng là 0.48 mol.
Tiếp theo, ta tính khối lượng mol của FeOx:
Khối lượng mol = khối lượng / số mol
Khối lượng mol FeOx = 27.84g / 0.48 mol = 58g/mol (khoảng chừng)
Công thức phân tử của oxit sắt có thể xác định bằng cách so sánh khối lượng mol với khối lượng mol của các nguyên tố trong bảng tuần hoàn. Với khối lượng mol xấp xỉ 58g/mol, ta có thể suy ra rằng công thức phân tử của oxit sắt là Fe2O3.
Để tính nồng độ mol/l của dung dịch sau phản ứng, ta chia số mol H2SO4 cho thể tích dung dịch sau phản ứng (480ml):
Nồng độ mol/l = số mol / thể tích (l)
Nồng độ mol/l của dung dịch sau phản ứng:
= 0.48 mol / 0.48 l = 1M
Vậy, nồng độ mol/l của dung dịch sau phản ứng là 1M.
Đúng 0
Bình luận (0)
Cho 0,1 mol một oxit sắt tác dụng vừa đủ với dung dịch HCl 2M.
a. Xác định công thức của oxit sắt trên biết lượng muối thu được là 32,5 gam, từ đó tính thể tích của dung dịch HCl 2M cần dùng.
b. Lượng HCl dùng trong thí nghiệm trên có thể trung hòa bao nhiêu gam dung dịch Ba(OH)2 17,1%.
a)\(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH2O\)
Ta có: \(n_{FeCl_{\dfrac{2y}{x}}}=xn_{Fe_xO_y}=0,1x\left(mol\right)\)
\(\Rightarrow M_{FeCl_{\dfrac{2y}{x}}}=\dfrac{32,5}{0,1x}\)
| x | 1 | 2 | 3 |
| \(M_{FeCl_{\dfrac{2y}{x}}}\) | 325(loại) | 162,5(TM) | 108,33(loại) |
=> Muối có CT: \(FeCl_2\Rightarrow\)CT oxit là FeO
\(FeO+2HCl\rightarrow FeCl_2+H2O\)
0,1---->0,2(mol)
\(\Rightarrow V_{HCl}=\dfrac{0,2}{2}=0,1\left(l\right)\)
b) \(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H2O\)
0,1<---------------0,2
\(\Rightarrow m_{Ba\left(OH\right)2}=0,1.171=17,1\left(g\right)\)
\(\Rightarrow m_{dd}=\dfrac{17,1.100}{17,1}=100\left(g\right)\)
Chúc bạn học tốt ^^
Đúng 3
Bình luận (0)
bài 1 a/ Oxit X có công Thức RO3, tác dụng với dung dịch NaOH dư tạo 1 muối có chứa 22,54% R. Xác định CTHH của X.
b/ Để hòa tan 23,2g một oxit của sắt ( FexOy) cần dùng đủ 200ml dung dịch HCl 4M ( D=1,1 g/m). Xác định CTHH của oxit sắt và C% các muối trong dung dịch thu được
Một oxit sắt có khối lượng 25,52 gam. Để hòa tan hết lượng oxit sắt này cần dùng vừa đủ 220 ml dung dịch H2SO4 2M (loãng). Công thức của oxit sắt này là: A. Fe3O4 B. Fe2O3 C. FeO D. FeO hoặc Fe2O3
Đọc tiếp
Một oxit sắt có khối lượng 25,52 gam. Để hòa tan hết lượng oxit sắt này cần dùng vừa đủ 220 ml dung dịch H2SO4 2M (loãng). Công thức của oxit sắt này là:
A. Fe3O4
B. Fe2O3
C. FeO
D. FeO hoặc Fe2O3
Đáp án A
25,52 gam FexOy + 0,44 mol H2SO4.
Giả sử oxit sắt gồm FeO a mol và Fe2O3 b mol.
FeO + H2SO4 → FeSO4 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Lập hpt:
72 a + 160 b = 25 , 52 a + 3 b = 0 , 44 → a = 0 , 11 b = 0 , 11
→ Oxit sắt là Fe3O4 (Fe3O4 = FeO.Fe2O3)
Đúng 0
Bình luận (0)
Một oxit sắt có khối lượng 25,52 gam. Để hòa tan hết lượng oxit sắt này cần dùng vừa đủ 220 ml dung dịch H2SO4 2M (loãng). Công thức của oxit sắt này là A. Fe3O4 B. Fe2O3 C. FeO D. FeO hoặc Fe2O3
Đọc tiếp
Một oxit sắt có khối lượng 25,52 gam. Để hòa tan hết lượng oxit sắt này cần dùng vừa đủ 220 ml dung dịch H2SO4 2M (loãng). Công thức của oxit sắt này là
A. Fe3O4
B. Fe2O3
C. FeO
D. FeO hoặc Fe2O3
hòa tan 4g oxit sắt FexOy dùng vừa đủ cho 52,16ml dung dịch HCL10%(d=1,05g/ml)
viết pthh của phản ứng xảy ra
tìm công thức của oxi sắt trên
\(n_{HCl} =\dfrac{52,16.1,05.10\%}{36,5} = 0,15(mol)\\ Fe_xO_y + 2yHCl \to xFeCl_{\dfrac{2y}{x}} + yH_2O\\ n_{Fe_xO_y} = \dfrac{n_{HCl}}{2y} = \dfrac{0,075}{y}(mol)\\ \Rightarrow \dfrac{0,075}{y}.(56x + 16y) = 4\\ \Rightarrow \dfrac{x}{y} =\dfrac{2}{3}\)
Vậy CTHH của oxit : Fe2O3
Đúng 1
Bình luận (0)
hòa tan 1,62 gam một oxit kim loại X cần dùng vừa đủa 20ml dung dịch h2so4 1m .tìm công thức hóa học của oxit trên
Gọi CTHH của oxit là $X_2O_n$
$X_2O_n + nH_2SO_4 \to X_2(SO_4)_n + nH_2O$
Theo PTHH :
$n_{oxit} = \dfrac{n_{H_2SO_4}}{n} = \dfrac{0,02}{n}(mol)$
$\Rightarrow \dfrac{0,02}{n}.(2X + 16n) = 1,62$
$\Rightarrow X = \dfrac{65}{2}n$
Với n = 2 thì $X = 65(Zn)$
Vậy oxit là $ZnO$
Đúng 2
Bình luận (0)
Hòa tan hết 4,0g oxit FexOy cần dùng 52,14 ml dung dịch HCl 10% (D = 1,05g/ml). Để khử hóa hoàn toàn 4,0g oxit sắt này cần ít nhất thể tích khí CO (đktc) là:
A. 1,68 lít.
B. 1,545 lít.
C. 1,24 lít
D. 0,056 lít.