Cho em hỏi TCVL và TCHH của oxi và ozon(O2 ,03) cách điều chế

Những câu hỏi liên quan
Cho các phát biểu sau:(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),...(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp.(3) Khí ozon không màu, không mùi, tan nhiều trong nước.(4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon.(5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt.(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit. Số phát biểu đúng là: A. 2. B. 1. C. 3. D. 4.
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),...
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp.
(3) Khí ozon không màu, không mùi, tan nhiều trong nước.
(4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon.
(5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt.
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit.
Số phát biểu đúng là:
A. 2.
B. 1.
C. 3.
D. 4.
Đáp án A
Các trường hợp thoả mãn: 1 – 4
Đúng 0
Bình luận (0)
Cho các phát biểu sau: (1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),... (2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp. (3) Khí ozon không màu, không mùi, tan nhiều trong nước. (4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon. (5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt. (6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit. Số phát biểu đúng là: A. 2. B. 1. C. 3. D. 4
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),...
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp.
(3) Khí ozon không màu, không mùi, tan nhiều trong nước.
(4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon.
(5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt.
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit.
Số phát biểu đúng là:
A. 2.
B. 1.
C. 3.
D. 4
ĐÁP ÁN A
Các trường hợp thoả mãn: 1 – 4
Đúng 0
Bình luận (0)
Cho các phát biểu sau: (1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn), … (2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp (3) Khí ozon không màu, không mùi, tan nhiều trong nước (4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi (5) Ozon oxi hóa hầu hết các kim loại kể cả Au, Pt (6) Ở điều kiện bình thường, oxi và ozon có thể oxi hóa bạc thành bạc oxit Số phát biểu đúng là: A.2 B.1 ...
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn), …
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp
(3) Khí ozon không màu, không mùi, tan nhiều trong nước
(4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi
(5) Ozon oxi hóa hầu hết các kim loại kể cả Au, Pt
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hóa bạc thành bạc oxit
Số phát biểu đúng là:
A.2
B.1
C.3
D.4
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),
(4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi
ĐÁP ÁN A
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm người ta điều chế CuO=cách dùng O2 oxi hóa Cu ở nhiệt độ cao
a Tính số gam Cu và O2 cần đung để điều chế 2,4g CuO
b Tính số gam KCIO3 cần dùng để điều chế lượng O2 cần dùng cho phản ứng trên
a, Ta có: \(n_{CuO}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
____0,03_0,015___0,03 (mol)
\(\Rightarrow m_{Cu}=0,03.64=1,92\left(g\right)\)
\(m_{O_2}=0,015.32=0,48\left(g\right)\)
b, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,01\left(mol\right)\Rightarrow m_{KClO_3}=0,01.122,5=1,225\left(g\right)\)
Đúng 2
Bình luận (0)
Cho các phát biểu sau:(1) Trong công nghiệp Oxi được điều chế duy nhất bằng cách điện phân nước vì có chi phí rẻ.(2) Ozon là một dạng thù hình của Oxi, có tính oxi hóa rất mạnh và có tác dụng diệt khuẩn do vậy trong không khí có Ozon làm cho không khí trong lành.(3) Ozon được dùng để tẩy trắng tinh bột, dầu ăn. Chữa sâu răng. Sát trùng nước sinh hoạt…(4) Lưu huỳnh có hai dạng thù hình là lưu huỳnh tà phương và lưu huỳnh đơn tà.(5) Cho Fe vào dung dịch H2SO4 đặc nguội thu được khí H2.Số phát biểu...
Đọc tiếp
Cho các phát biểu sau:
(1) Trong công nghiệp Oxi được điều chế duy nhất bằng cách điện phân nước vì có chi phí rẻ.
(2) Ozon là một dạng thù hình của Oxi, có tính oxi hóa rất mạnh và có tác dụng diệt khuẩn do vậy trong không khí có Ozon làm cho không khí trong lành.
(3) Ozon được dùng để tẩy trắng tinh bột, dầu ăn. Chữa sâu răng. Sát trùng nước sinh hoạt…
(4) Lưu huỳnh có hai dạng thù hình là lưu huỳnh tà phương và lưu huỳnh đơn tà.
(5) Cho Fe vào dung dịch H2SO4 đặc nguội thu được khí H2.
Số phát biểu đúng là:
A. 2
B. 3
C. 4
D. Đáp án khác
Chọn đáp án A.
(1) Sai. Có thể điều chế bằng cách chưng cất phân đoạn không khí lỏng.
(2) Sai. Chỉ khi lượng O3 rất nhỏ mới có tác dụng làm không khí trong lành. Nếu hàm lượng lớn sẽ có hại cho con người.
(3) Đúng. Theo SGK lớp 10.
(4) Đúng. Theo SGK lớp 10.
(5) Sai. Không có phản ứng xảy ra.
Đúng 0
Bình luận (0)
Cho các phát biểu sau: (1) Trong công nghiệp Oxi được điều chế duy nhất bằng cách điện phân nước vì có chi phí rẻ. (2) Ozon là một dạng thù hình của Oxi, có tính oxi hóa rất mạnh và có tác dụng diệt khuẩn do vậy trong không khí có Ozon làm cho không khí trong lành. (3) Ozon được dùng để tẩy trắng tinh bột, dầu ăn. Chữa sâu răng. Sát trùng nước sinh hoạt… (4) Lưu huỳnh có hai dạng thù hình là lưu huỳnh tà phương và lưu huỳnh đơn tà. (5) Cho Fe vào dung dịch H2SO4 đặc nguội thu được khí H2. Số phá...
Đọc tiếp
Cho các phát biểu sau:
(1) Trong công nghiệp Oxi được điều chế duy nhất bằng cách điện phân nước vì có chi phí rẻ.
(2) Ozon là một dạng thù hình của Oxi, có tính oxi hóa rất mạnh và có tác dụng diệt khuẩn do vậy trong không khí có Ozon làm cho không khí trong lành.
(3) Ozon được dùng để tẩy trắng tinh bột, dầu ăn. Chữa sâu răng. Sát trùng nước sinh hoạt…
(4) Lưu huỳnh có hai dạng thù hình là lưu huỳnh tà phương và lưu huỳnh đơn tà.
(5) Cho Fe vào dung dịch H2SO4 đặc nguội thu được khí H2.
Số phát biểu đúng là:
A. 2
B. 3
C. 4
D. Đáp án khác
Chọn đáp án A.
(1) Sai. Có thể điều chế bằng cách chưng cất phân đoạn không khí lỏng.
(2) Sai. Chỉ khi lượng O3 rất nhỏ mới có tác dụng làm không khí trong lành. Nếu hàm lượng lớn sẽ có hại cho con người.
(3) Đúng. Theo SGK lớp 10.
(4) Đúng. Theo SGK lớp 10.
(5) Sai. Không có phản ứng xảy ra
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao. a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ? b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
Đọc tiếp
Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 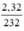 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, người ta điều chế Fe3O4 bằng cách dùng oxi để oxi hoá sắt ở nhiệt độ cao.
a/ Tính thể tích O2 ở ĐKTC cần dùng để điều chế được 2,32g Fe3O4.
b/ Tính số gam kalipemanganat KMnO4 cần dùng để có được lượng O2 dùng cho phản ứng trên.
PTHH: 3Fe + \(2O_2\) --->\(Fe_3O_4\)
theo pt: 3_____2_____________1
theo đề: x______y_____________0.01
nFe3O4 là: 0.01mol
\Rightarrow nO2= 0.01*2/1=0.02 mol
VO2= 0.02*22.4=0.448l
b, PTHH : 2KMnO4 ----> K2MnO4 + MnO2 + O2
theo pt: 2__________1________1______1
theo đề: x___________________________0.02
=> n KMnO4= 0.02*2/1= 0.04 mol
=>mKMnO4= 0.04*158=6.32g
Đúng 0
Bình luận (0)
a. số mol của là :
2.32 : 232 =0.01 mol
theo tỉ lệ mol ta có số mol của Fe là:
0.01 * 3 = 0.03 mol
khối lượng sắt là: 0.03*56=1.68g
số mol oxi là: 0.01*2=0.02mol
thể tích oxi là: 0.02*22.4= 0.448g
b. 2KMnO_4 ---> K2MnO4 + MnO2 + O2
---> nKMnO_4 = 2nO2 = 0,04 mol ---> mKMnO_4=0.04*158=6.32g
Đúng 0
Bình luận (0)
a, nFe3O4 = \(\dfrac{m}{M}\)= \(\dfrac{2,32}{232}\)=0,01(mol)
pt: 3Fe + 2O2 --to-> Fe3O4 (1)
Từ pứ (1) => \(n_{Fe}=3.n_{Fe3O4}=3.0,01=0,03\left(mol\right)\)
=> mFe= n.M=0,03.56=1,68(g)
Từ pứ (1)=> \(n_{^{O2}}=2.n_{^{Fe3O4}}=2.0,01=0,02\)
=>mO2=n.M=0,02.32=0,64(g)
Vậy cần 1,68g Fe và 0,64g O2 để điều chế 2,32g oxits sắt từ
Đúng 0
Bình luận (0)
trong phòng thí nghiệm người ta phải điều chế oxi bằng cách nhiệt phân KCLO 3 \(\underrightarrow{to}\)KCL+ O2 . Tính khối lg KCLO3 cần dùng để điều chế 9,6 g oxi . Tính khối lg KCL dc tạo thành
Ta có : \(n_{O_2} = \dfrac{9,6}{32} = 0,3(mol) \)
Phương trình hóa học :
\(2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\)
Theo PTHH :
\(n_{KClO_3} = n_{KCl} = \dfrac{2}{3}n_{O_2} = 0,2(mol)\)
Vậy :
\(m_{KClO_3} = 0,2.122,5 = 24,5(gam)\\ m_{KCl} = 0,2.74,5 = 14,9(gam)\)
Đúng 3
Bình luận (0)















