Dung dịch X chứa NaHCO3 và Na2CO3 với nồng độ mol bằng nhau. Đổ từ từ dd X vào dd Y chứa 0,3 mol HCl. Tính V_CO2 thu đc sau phản ứng
HELP MEEE!!!!
Dung dịch X có chứa m gam chất tan gồm Na2CO3 và NaHCO3. Nhỏ từ từ 0,3 mol HCl đến hết vào dung dịch X thì sau phản ứng thu được dung dịch Y và thoát ra 0,1 mol khí CO2. Nhỏ nước vôi trong đến dư vào dung dịch Y thì được 40 gam kết tủa. Giá trị m là
A. 48,6
B. 39,1
C. 38,0
D. 46,4
Hòa tan hỗn hợp Na2CO3, NaHCO3, Ba(HCO3)2 (trong đó số mol Na2CO3 và NaHCO3 bằng nhau) vào nước lọc thu được dung dịch X và m gam kết tủa Y. Chia toàn bộ dung dịch X thành hai phần bằng nhau. Phần 1 phản ứng vừa đủ với dung dịch chứa 0,08 mol NaOH. Nhỏ từ từ dung dịch HCl vào phần 2 đến khi lượng khí thoát ra là lớn nhất thì tốn hết 0,12 mol HCl. Giá trị m là
A. 4,925 gam
B. 1,970 gam
C. 3,940 gam
D. 7,880 gam.
Đáp án D
Gọi n N a 2 C O 3 = x ; n N a H C O 3 = x và n B a ( H C O 3 ) 2 = y
Khi hòa tan hỗn hợp vào nước có phản ứng:
![]()
Khi đó trong dung dịch X có NaHCO3, Ba(HCO3)2 dư hoặc Na2CO3.
Dù thành phần của dung dịch X như thế nào thì toàn bộ số mol trong hỗn hợp ban đầu và trong dung dịch X là như nhau.
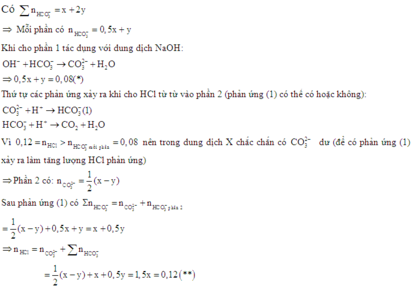
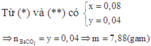
Cho từ từ 450 ml dd HCl 1M vào 500 ml dung dịch X gồm Na2CO3 và NaHCO3 thì thu được 5,6 lít khí (đktc) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thì thu được 19,7 gam kết tủa. Nồng độ mol của Na2CO3 và NaHCO3 trong dung dịch X lần lượt là:
A. 0,2M và 0,15M
B. 0,2M và 0,3M
C. 0,3M và 0,4M
D. 0,4M và 0,3M
Đổ từ từ 0,3 mol HCl vào dung dịch chứa 0,1 mol NaOH, 0,15 mol Na2CO3, sau phản ứng thu được a mol CO2 và dung dịch A. Thêm Ba(OH)2 vào A thu được m gam kết tủa. Giá trị a và m
NaOH + HCl → NaCl + H2O
0,1...........0,1.................................(mol)
Na2CO3 + HCl → NaCl + NaHCO3
0,15............0,15.....................0,15..........(mol)
NaHCO3 + HCl → NaCl + CO2 + H2O
0,05............0,05...................0,05.............(mol)
=> a = 0,05
Bảo toàn nguyên tố C :
n BaCO3 = n NaHCO3 dư = 0,15 - 0,05 = 0,1(mol)
=> m = 0,1.197 = 19,7(gam)
Cho từ từ đến hết dung dịch chứa 0,48 mol HCl vào dung dịch X chứa đồng thời x mol Na2CO3 và 0,2 mol NaHCO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,032 lít CO2 (đktc). Giá trị của x là
A. 0,15
B. 0,28
C. 0,14
D. 0,30
Cho từ từ đến hết dung dịch chứa 0,48 mol HCl vào dung dịch chứa đồng thời x mol N a 2 C O 3 và 0,2 mol N a H C O 3 . Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,032 lít C O 2 (đktc). giá trị của x là
A. 0,15
B. 0,28
C. 0,14
D. 0,30
Nhỏ từ từ 200ml dung dịch HCl vào 100ml dung dịch X chứa Na2CO3, K2CO3, NaHCO3 (trong đó NaHCO3 có nồng độ 1M), thu được 1,12 lít CO2 (đktc) và dung dịch Y. Cho nước vôi trong dư vào dung dịch Y thu được 20 gam kết tủa. Nồng độ mol/l của dung dịch HCl là:
A. 1,25M
B. 0,5M
C. 1,0M
D. 0,75M
Gọi thể tích của dung dịch HCl là V(lít)
Các phản ứng
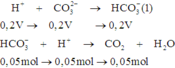
Sau phản ứng cho nước vôi trong dư vào dung dịch Y thì được kết tủa
Trong dung dịch Y còn chứa anion H C O 3 - ⇒ H+ phản ứng hết.
Sau (1), (2) có n H C O 3 - còn lại = 0,2V – 0,05 + 0,1 = 0,2V + 0,05
Khi cho nước vôi trong vào dung dịch Y ta có phản ứng sau:
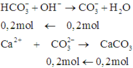
Do đó, ta có 0,2V + 0,05 = 0,2 mol ⇒ V = 0,75
Tổng số mol HCl là: 0,2V + 0,05 = 0,2 . 0,75 + 0,05 = 0,2 mol
Nồng độ của HCl: C M = n v = 0 , 2 0 , 2 = 1 M
Đáp án C.
Dung dịch X có chứa: 0,1 mol Na2CO3; 0,1 mol K2CO3 và 0,3 mol NaHCO3. Thêm từ từ Vml dung dịch HCl 1M vào dung dịch X thu được dung dịch Y và 3,36 lít khí (đktc). Giá trị của V là
A. 250ml
B. 300ml
C. 350ml
D. 400ml
Hòa tan hết m gam hỗn hợp M gồm Na, Na2O, Ba và BaO vào nước, thu được 0,3 mol khí H2 và dung dịch X. Sục 0,64 mol khí CO2 vào dung dịch X, thu được dung dịch Y chỉ chứa các ion Na+, HCO3-, CO32- và kết tủa Z. Chia dung dịch Y thành 2 phần bằng nhau và tiến hành 2 thí nghiệm:
- Thí nghiệm 1: Cho từ từ đến hết phần 1 vào dung dịch chứa 0,24 mol HCl, thu được 0,15 mol CO2, coi tốc độ phản ứng của HCO3-, CO32- với H+ bằng nhau.
- Thí nghiệm 2: Cho từ từ đến hết dung dịch chứa 0,24 mol HCl vào phần 2, thu được 0,12 mol CO2.
Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 29,14.
B. 51,76.
C. 25,88.
D. 58,28.