. Cho 5,94 gam hỗn hợp X gồm Na2CO3; K2CO3 tác dụng hết với 300 ml dung dịch HCl sinh ra 1,12 lít CO2 (đktc).
a. Tính thành phần phần trăm theo khối lượng của 2 muối trong hỗn hợp X.
b. Tính nồng độ phần phần các chất trong dung dịch sau phản ứng.
Cho 5,94 gam hỗn hợp K2CO3 và Na2CO3 tác dụng với dung dịch H2SO4 dư thu được 7,74 gam hỗn hợp các muối khan K2SO4 và Na2SO4. Thành phần của hỗn hợp ban đầu là
A. 3,18 gam Na2CO3 và 2,76 gam K2CO3 C. 3,02 gam Na2CO3 và 2,25 gam K2CO3
B. 3,81 gam Na2CO3 và 2,67 gam K2CO3 D. 4,27 gam Na2CO3 và 3,82 gam K2CO3
Gọi $n_{K_2CO_3} = a(mol) ; n_{Na_2CO_3} = b(mol) \Rightarrow 138a + 106b = 5,94(1)$
\(K_2CO_3+H_2SO_4\rightarrow K_2SO_4+CO_2+H_2O\)
a...................................a....................................(mol)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
b.......................................b..................................(mol)
Suy ra: $174a + 142b = 7,74(2)$
Từ (1)(2) suy ra a = 0,02 ; b = 0,03
$m_{K_2CO_3} = 0,02.138 = 2,76(gam)$
$m_{Na_2CO_3} = 0,03.106 = 3,18(gam)$
Đáp án A
Cho 5,94 g hỗn hợp K2CO3 và Na2CO3 tác dụng với dung dịch H2SO4 dư thu được 7,74 g hỗn hợp các muối khan K2SO4 và Na2SO4. Thành phần hỗn hợp đầu là:
A. 3,18 g Na2CO3 và 2,76 g K2CO3
B. 3,81 g Na2CO3 và 2,67 g K2CO3
C. 3,02 g Na2CO3 và 2,25 g K2CO3
D. 4,27 g Na2CO3 và 3,82 g K2CO3
- Đáp án A
- Gọi số mol của Na2CO3 là x và của K2CO3 là y mol
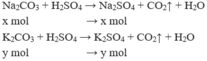
Ta có hệ phương trình:
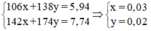
⇒ mNa2CO3= 106.0,03 = 3,18 (gam)
mK2CO3= 138.0,02 = 2,76 (gam)
⇒ Đáp án A
Nung 100 gam hỗn hợp A gồm Na2CO3 và NaHCO3 cho đến khi khối lượng của hỗn hợp không đổi, được 69 gam chất rắn. Thành phần phần trăm về khối lượng của Na2CO3 trong hỗn hợp A là
A. 16%.
B. 44%.
C. 84%.
D. 32%.
Hỗn hợp X gồm 2 este đơn chức. Cho 0,3 mol hỗn hợp X tác dụng vừa đủ với dung dịch NaOH, Thu được dung dịch Y. Cô cạn dung dịch Y thu được hỗn hợp Z gồm hai muối khan. Đốt cháy hoàn toàn Z thu được 55 gam CO2; 26,5 gam Na2CO3 và m gam H2O. Giá trị của m là
A. 17,1
B. 15,3
C. 8,1
D. 11,7
Hỗn hợp X gồm 2 este đơn chức. Cho 0,6 mol hỗn hợp tác dụng vừa đủ với dung dịch NaOH sau phản ứng hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được hỗn hợp Z gồm hai muối khan. Đốt cháy hoàn tòan Z thu được 110 gam CO2; 53 gam Na2CO3 m gam H2O. m=?
A. 34,20
B. 30,60
C. 16,20
D. 23,40
Đáp án D
![]()
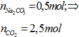 Este của phenol: 0,04 mol
Este của phenol: 0,04 mol
BTNT “C”: 0,6(n + 1) + 0,4(m + 6)=3
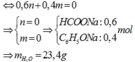
Hỗn hợp X gồm 2 este đơn chức. Cho 0,6 mol hỗn hợp tác dụng vừa đủ với dung dịch NaOH sau phản ứng hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được hỗn hợp Z gồm hai muối khan. Đốt cháy hoàn tòan Z thu được 110 gam CO2; 53 gam Na2CO3 m gam H2O. m=?
A. 34,20
B. 30,60
C. 16,20
D. 23,40
Hỗn hợp X gồm 2 este đơn chức. Cho 0,6 mol hỗn hợp tác dụng vừa đủ với dung dịch NaOH sau phản ứng hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được hỗn hợp Z gồm hai muối khan. Đốt cháy hoàn tòan Z thu được 110 gam CO2; 53 gam Na2CO3 m gam H2O. m=?
A. 34,20
B. 30,60
C. 16,20
D. 23,40
Hòa tan hết 14,6 gam hỗn hợp gồm Zn và ZnO có tỷ lệ mol 1:1 trong 250 gam dung dịch HNO3 12,6% thu được dung dịch X và 0,336 lít khí Y (đktc). Cho từ từ 740 ml dung dịch KOH 1M vào dung dịch X thu được 5,94 gam kết tủa. Nồng độ phần trăm của muối trong dung dịch X là:
A. 28,02%
B. 14,29%
C. 12,37%
D. 14,32%
Định hướng tư duy giải
Ta có:
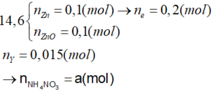
Có NH4NO3 vì nếu Y là N2
→ n e Max = 0 , 15 < 0 , 2 .
Sau khi cho KOH vào thì K nó chạy đi đâu? Việc trả lời CÂU hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
0,74 mol KOH + X
→ BTNT . K n K N O 3 = 0 , 74 - 0 , 14 . 2 = 0 , 46 m o l n K 2 Z n O 2 = 0 , 2 - 0 , 06 = 0 , 14 m o l
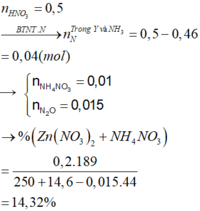
Hòa tan hết 14,6 gam hỗn hợp gồm Zn và ZnO có tỉ lệ mol 1:1 trong 250 gam dung dịch HNO3 12,6% thu được dung dịch X và 0,336 lít khí Y (đktc). Cho từ từ 740ml dung dịch KOH 1M vào dung dịch X thu được 5,94 gam kết tủa. Nồng độ phần trăm của Zn(NO3)2 trong dung dịch X là:
A. 28,02%
B. 14,29%
C. 14,32%
D. 12,37%
Ta có nZn = nZnO = 0,1 mol, nHNO3 = 0,5 mol
Kết tủa thu được là Zn(OH)2: 0,06 mol
Vậy dung dịch sau phản ứng + KOH chứa K2ZnO2: (0,1 + 0,1 - 0,06) = 0,14 mol và KNO3: (0,74 - 2 × 0,14) = 0,46 mol
Bảo toàn nguyên tố N → nN (Y) + nNH4 + = 0,5 - 0,46 = 0,04 mol
Nếu khí Y chứa 1 nguyên tố N (NO và NO2) → nNH4+ = 0,04 - 0,015 = 0,025
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,025×80,015 = 0 (Vô lý)
Vậy khí Y chứa 2 nguyên tố N (N2, N2O) → nNH4+ = 0,04 - 0,015 × 2 = 0,01 mol
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,01×80,015 = 8 → khí tạo thành là N2O
Bảo toàn khối lượng → mdd = 14,6 + 250 - 0,015 × 44 = 263,94 gam
C% Zn(NO3)2 = (0,2×189/ 263,94 )×100% = 14,32%
Đáp án C