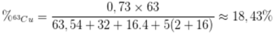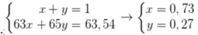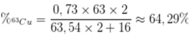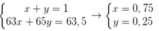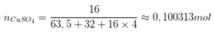Câu 1: Trong tự nhiên, nguyên tố đồng có hai đồng vị là 63Cu và 65Cu. Trong đó 65Cu chiếm 27% về số nguyên tử. Số nguyên tử của đồng vị 63Cu trong 7,154 gam Cu2O là? (biết O=16)
Câu 2: Hãy tìm số nguyên tử hidro có trong 6 ml nước. Biết khối lượng riêng của nước là 1 g/ml. (biết O=16; H=1)
Câu 3: Clo có hai đồng vị bền 35Cl(chiếm 75%), 37Cl. Số nguyên tử đồng vị 37Cl có trong 2,22 gam CaCl2 là? (biết Ca=40)